科学家发现了新的凝血之谜
伯明翰的科学家们描述了一种抗血栓治疗的潜在新靶点和策略,这项研究为血液凝固在感染性和炎症性疾病中的作用提供了新的视角。
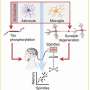
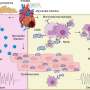
他们的发现提出了一种新的机制血小板激活涉及结合蛋白S100 A8/A9到GPIbα血小板受体,以前没有被描述为抗凝治疗的靶点。
由心血管科学研究所伯明翰血小板组的Martina Colicchia博士和Julie Rayes博士进行的这些研究的结果将在ESC大会20218月27日。
S100A8/A9在白细胞(中性粒细胞)中表达,是一种危险相关分子模式(DAMP),包括在疾病或疾病期间启动炎症反应的不同分子家族。
S100 A8/A9通常储存在细胞内,在感染或炎症期间被释放到循环中,在那里它激活了其他免疫细胞。在动脉粥样硬化、心肌梗死(心梗)后发生的心肌缺血再灌注损伤、心脏手术或循环停跳、心力衰竭和感染(如COVID-19)等心血管疾病中,其水平升高。心肌梗死后S100 A8/A9水平高也与支架内晚期血栓形成和心力衰竭的高风险相关。
研究人员从重症监护病房的COVID-19患者的血液中开始了他们的调查,结果显示,严重疾病患者(n=87)的血浆中S100 A8/A9持续高水平(10-40µg/ml)。回顾性分析显示非存活ICU患者S100 A8/A9平均水平持续升高(重症监护室)患者,从第一次抽血后的第二天开始。在那些存活下来的人体内,维生素d水平从第二天开始下降。通过观察COVID-19肺解剖,他们还发现致命COVID-19患者肺部的血小板-中性粒细胞相互作用增加。
根据这些发现,研究人员将注意力转向S100 A8/A9是否或如何影响血小板功能,并发现重组人S100 A8/A9在健康人类血液样本中诱导促凝血小板的形成,这是一组支持凝血的血小板。
血小板活化水平显著且浓度依赖,并在使用一系列促凝标记物的研究中得到证实。经检测并显示可诱导促凝血小板的S100A8/A9水平在COVID-19患者血浆中观察到的S100A8/A9水平范围内。
令人惊讶的是,他们的研究结果表明,虽然重组S100 A8/A9不会诱导血小板聚集,但它确实会诱导全血中纤维蛋白的生成。
朱莉·雷耶斯博士评论说:“这些发现令人兴奋。最近研究显示,促凝血小板的存在及其对COVID-19患者血栓形成和预后恶化的贡献。然而,促凝血小板的诱导机制以及如何阻断尚不清楚。在这里,我们描述了一种促凝血小板形成的新机制,并确定GPIbα是这种作用的原因。”
然后,研究人员测试了S100 A8/A9诱导的血小板活化是否可以通过抗血小板药物和非甾体抗炎药或针对已知的血小板活化受体适用于s100a8 /A9。他们没有看到这些已知受体靶点的药物的作用,然而小鼠研究表明,重组小鼠S100A8/A9通过GPIbα受体诱导促凝血小板的形成,该受体以前没有被描述为S100A8/A9的受体和DAMPs的靶点。
使用人类血小板的研究证实了这一点,表明重组GP1bα抑制S100A8/A9的激活(通过p -选择素表达、GPIIbIIIa激活和磷脂酰丝氨酸暴露来测量)。通过对从Bernard Soulier综合征(一种罕见的遗传性疾病,导致血小板缺乏GPIbα受体)患者分离的血小板进行测试,进一步证实了这一点,在任何剂量水平下,S100 A8/A9都不能对GPIbα受体产生反应。
Colicchia博士评论说:“我们已经描述了一种由S100A8/A9介导的促凝血小板形成的新机制,它在血小板上起DAMP作用,并导致纤维蛋白生成和血栓形成。重要的是,这种血栓形成原途径对经典的抗血栓形成原途径具有抗性血小板药物。GPIbα受体以前被认为是一种几乎没有信号的粘附受体,但我们的研究表明,这种尚未完全阐明的途径可能是急性和慢性炎症疾病(包括COVID-19患者和心血管疾病患者)血栓预防和治疗的新靶点。”
近日,伯明翰大学企业学院提交了一项广泛的专利申请,涵盖S100A8/A9和GPIbα受体在治疗和预防炎症性和血栓性疾病中的相互作用。
研究人员正在继续研究基本机制和途径,并欢迎研究合作者或能够提供COVID-19患者血清或血浆的医院询问。