科学家发现关键作用的蛋白质参与肌萎缩性脊髓侧索硬化症病
世界著名的理论物理学家斯蒂芬•霍金被诊断患有肌萎缩性脊髓侧索硬化症(ALS) 21岁的时候。ALS是一种少见的运动神经元疾病,通常会影响个人60岁以上的老人。霍金了55年,违抗。霍金的疾病,另一方面,是一个异常,因为绝大多数患者确诊后活就在2 - 4年。尽管这种疾病是罕见的,它有一个主要因为人们遭受运动退化和社会经济影响,最终,瘫痪。
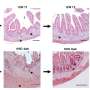
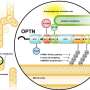
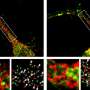
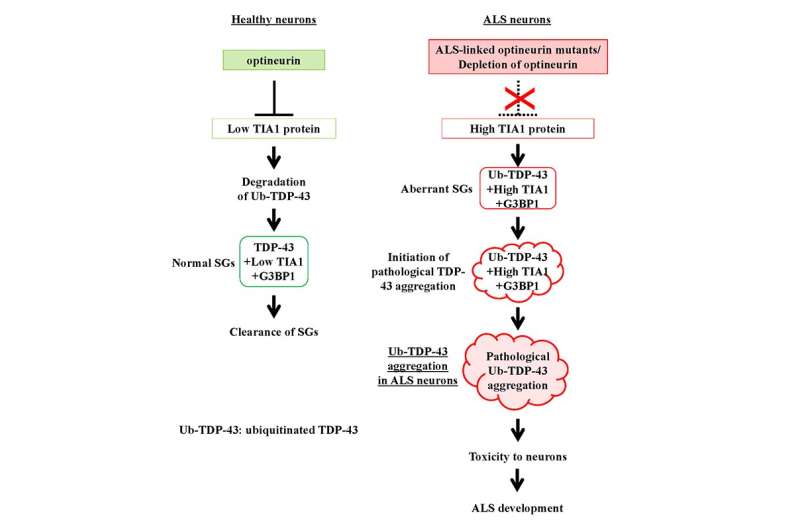
尽管ALS的原因尚不清楚,日本的一个科学家小组Masahiro藤井教授为首的新泻大学研究生院医学和牙科科学和大脑研究所揭示潜在的病因机制方面取得了显著的进步。的积累ubiquitinated TDP-43 (Ub-TDP-43)蛋白质聚集在运动神经元ALS的标志,藤井教授和他的同事们已经表明,蛋白optineurin (OPTN)抑制Ub-TDP-43总量在应激压力的形成颗粒(SGs),而OPTN突变体来源于SGs的ALS患者诱导Ub-TDP-43总量。
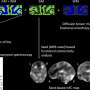
这些SGs生成细胞的细胞质中应对压力,包括热休克和氧化,并被消除时自发压力减少的程度。在最近的工作中,藤井教授和其他科学家,产生OPTN击倒(OPTN-KD)细胞,发现SGs的大小,增加延误SG间隙和SGs的累积Ub-TDP-43压力去除后,异常的SGs的特征。此外,他们建立了一个联系TIA1的表达增加,另一种蛋白质与ALS的发展。
这组科学家证明之间的直接联系OPTN-KD-induced增加TIA1蛋白质和Ub-TDP-43-positive SGs OPTN-KD细胞的形成。
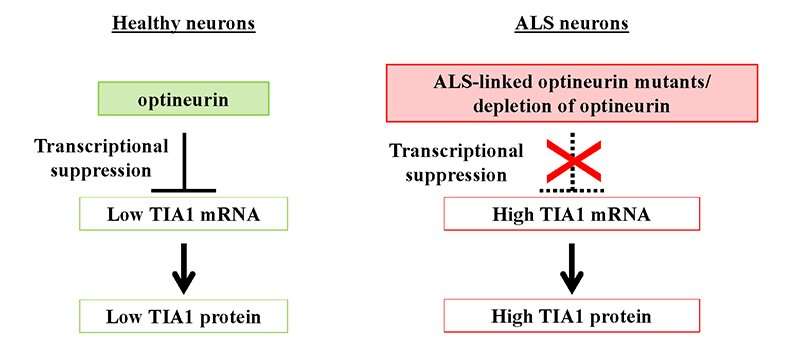
由于这些异常的SGs的延迟清关,神经元积累Ub-TDP-43总量,这显示神经元毒性,最终在ALS患者神经元变性特征。
“这一发现阐发的过程Ub-TDP-43聚集在ALS患者的大脑发展optineurin或TIA1突变和解释了ubiquitinated蛋白质聚集在肌萎缩性侧索硬化症等神经退行性疾病,”藤井教授在一次采访中解释道。
遗传变量,尤其是突变,在肌萎缩性侧索硬化症也很重要,特别是家族性肌萎缩性侧索硬化症。以前,OPTN和TIA1基因突变被确定为致病因素与TDP-43聚合病理学家族性肌萎缩性侧索硬化症。“我们的发现表明ALS-associated OPTN丧失突变增加的数量Ub-TDP-43神经元通过提高TIA1的表达,从而提高Ub-TDP-43聚合,”藤井教授补充说。
进一步理解OPTN抑制TIA1表达的机制,科学家们看着NF-κB信号通路,因为之前的研究表明,OPTN抑制NF-κB-mediated基因转录。另一方面,OPTN-KD TIA1信使rna的含量增加,而NF-κB抑制剂没有效果,表明这个过程不是NF-κB依赖。虽然是一个突破,本研究建立了一个重要OPTN和异常SG形成之间的联系,提高TIA1表达式,泛素化,和TDP-43聚合、未来研究努力的方向应该是理解的机制OPTN调节TIA1。
这项研究发表在iScience。
更多信息:太极Kakihana et al, optineurin / TIA1通路抑制异常压力形成颗粒,减少ubiquitinated TDP-43,iScience(2021)。DOI: 10.1016 / j.isci.2021.102733