循环肿瘤细胞和融合细胞精确分离和分子分析的新策略

一个世纪前,德国病理学家奥托·艾切尔(Otto Aichel)发现肿瘤细胞可以与免疫细胞融合,形成融合细胞,既具有免疫细胞的活力,又具有肿瘤细胞的致瘤能力,更容易通过循环系统扩散和转移。由于现有方法的局限性,这种融合细胞很难被完全分离和分析。
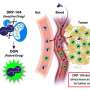
一项新研究发表在芯片实验室在6月28日提出了一种新的水动力结构,以实现一步和无标签的循环隔离肿瘤细胞(CTCs)和融合细胞(CFCs)。集成微流体平台分离出了高纯度和高细胞活力的稀有CTCs和cfc,实现了通过单细胞RNA测序直接下游分析。该研究由中国科学院深圳先进技术研究院陈燕博士团队领导。
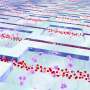
在本研究中,研究人员提出了一个过滤器确定性横向位移(filter- dld)概念,以实现一步和无标签的ctc和cfc分离。采用多物理方法设计并模拟了新型水动力结构有限元分析,这使得精确操纵细胞运动成为可能。
过滤器-DLD结构不仅具有比传统DLD设计更低的临界细胞分离尺寸,而且能够实现更高的小红细胞耗竭率,而小红细胞在血液中所占比例最大。
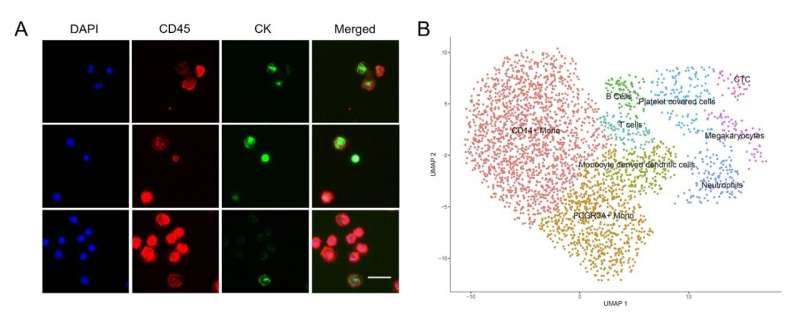
通过将filter-DLD概念与级联芯片设计相结合,研究人员充分挖掘了基于物理特性的稀有细胞分选的巨大潜力。该集成微流控平台在基于大小的细胞分离中表现出良好的性能,实现了高分离效率(>96%)、高细胞纯度(WBC去除率99.995%)、高细胞活力(>98%)和高处理速率(1mL/min)。
利用这个平台,研究人员分析了非小细胞肺癌患者的样本。有效收集CTCs和肿瘤细胞-白细胞融合细胞(cfc),并利用CTCs水平的变化监测治疗效果。因为富人们的生存能力极高细胞,可直接通过高通量单细胞RNA测序进行下游分析,研究癌症驱动基因和异质性。结果表明,癌症患者外周血中cfc含量高于ctc。氯氟烃有望揭示新的机制肿瘤为肿瘤的早期诊断、预后和监测提供了新的标志物。
总之,新的无标签罕见细胞分离策略是液体活检的一个强大工具,并为癌症诊断和治疗提供了巨大的希望。