新发现提高结直肠癌的理解

音乐目的就是癌症中心的研究人员发现了一个新颖的机制显示某一基因突变可以使肿瘤逃避免疫系统的检测在大肠癌患者。这项研究发表在7月22日致癌基因,就是最近的例子团队科学目的。
“工作是我们第一次意识到有人表明一个检查站抑制剂调控是由于损失的腺瘤息肉病杆菌(APC)基因功能,”雷蒙德·n·杜布瓦说,医学博士博士,目的就是癌症中心主任和该研究的资深作者。
结直肠癌是第三个最常见的恶性肿瘤和癌症死亡的第二大原因。在美国。虽然结肠镜检查是一种有效的方法来检测和防止息肉切除结肠直肠癌,结肠癌继续负责重要的死亡率。杜布瓦表示,现有疗法疗效有限在第四阶段疾病患者长期生存。
“这些患者的五年生存率是无法接受的,在5%和15%之间,这凸显了这一研究的重要性,”杜波依斯说。
杜波依斯实验室团队一直在努力理解导致结直肠癌的分子机制启动,增长和发展为发现新的策略来预防和拦截。
癌症的免疫反应是由co-stimulatory之间的平衡和抑制(关卡)通路。免疫检查站把刹车免疫系统,防止炎症组织损伤和自身免疫性疾病。例如,一个免疫检查点PD-L1通路被激活,免疫系统监管抑制免疫反应的分子与受体相互作用时,PD-1。
“PD-L1水平升高在多种人类癌症,包括结直肠癌,这有时会导致预后不良,”杜波依斯说。“我们知道,高水平的PD-L1癌细胞表面的相关肿瘤逃避免疫系统的能力。然而,确切的PD-L1在大肠癌中所扮演的角色还不清楚。一些报告在文献中出现相互矛盾的结果是否存在PD-L1指示性癌症预后的好坏。”
免疫系统以及如何逃避它
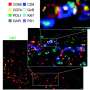
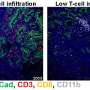
t细胞白细胞至关重要,有助于调节免疫系统,可以杀死癌细胞或病毒感染细胞。肿瘤细胞,因此,必须避开他们,如果他们生存直接损害细胞毒性t细胞的活性。肿瘤细胞抑制t细胞的扩散也采用免疫受体如PD-1检查站。PD-1和PD-L1交互抑制t细胞功能,同时增加免疫抑制的调控t细胞亚群)。虽然这复杂的舞蹈的t细胞,检查点受体和亚群发生,肿瘤细胞滑过去,逃避免疫系统。
APC突变连接
通常,人们拥有APC基因的两个副本,从父母那里继承下来的。APC基因为创建APC蛋白提供了指导,这有助于控制细胞分裂频率以及它如何连接到其他细胞在一个组织。因此,APC蛋白质作为一个肿瘤抑制,防止不受控制的细胞生长和分裂。如果一份APC基因突变,有机会增加发展中某些类型的癌症,如结肠直肠癌和其他癌症的胃、甲状腺、胰腺、肝脏和中枢神经系统。
以前的动物研究提供直接证据证明APC的损失导致腺瘤的形成,这是能够发生癌变的非癌变肿瘤。与β-catenin APC蛋白可以形成一个复杂的,在干细胞中扮演着重要的角色更新和再生器官。杜布瓦队进行了几个实验显示需要β-catenin APC突变和PD-L1水平上升。
杜波依斯的团队发现,在小鼠模型,APC基因突变PD-L1总是伴随着很高的水平。知识,他们开发了几个小鼠模型,他们把基因和检查对结肠的影响。
“当我们纠正的突变小鼠模型,检查点抑制剂走了,当我们重新引入突变,它返回,”杜波依斯解释说。
“这一发现是我们知道的第一个证据证明APC的损失导致刺激PD-L1在结肠癌细胞通过b-catenin PD-L1子复杂的绑定,”杜波依斯说。
他们的研究结果还揭示了一个新颖的机制APC突变使结肠肿瘤逃避免疫系统通过免疫检测检查点途径,增加了抗t细胞。“这些结果扩展我们对APC在结直肠癌中的作用的理解,为开发新的目标药物尽可能b-catenin抑制剂用于替代免疫抑制剂检查站在结直肠癌治疗,”杜波依斯说。这些新疗法可以拦截大肠癌中特别有用癌症疾病进展的非常早期的阶段。
杜波依斯的实验室计划调查的有效性结合使用检查点抑制剂与现有的疗法,如小分子药物。他希望这一发现将鼓励其他机构和相关研究的最终解释结肠直肠癌患者通常不免疫治疗反应良好。
“我们知道还有其他炎性通路抑制免疫系统攻击肿瘤细胞的能力不同免疫途径检查站。我们使用动物模型来测试化合物可以阻止这些炎症通路。现在我们使用的是那些除了检查点抑制剂,以及这两种方法的结合可能是改变游戏规则的和有效的新疗法。”
进一步探索