新型纳米粒子抑制癌症免疫疗法的耐药性
日本北海道大学的科学家和同事们发现了一种方法,可以帮助一些患者克服对癌症免疫疗法的耐药性。该方法已在小鼠实验中得到证实,并发表在癌症免疫治疗杂志。
免疫细胞表面的检查点蛋白的激活有助于调节免疫反应,防止它们不加区别地攻击身体的其他细胞。但是一些癌症细胞能够劫持这一机制,阻止针对它们的免疫反应。科学家们最近开发了免疫检查点抑制剂,可以对抗这种策略,但有些人对这种治疗方法有抗药性。
现在,北海道大学和爱知工业学院的科学家们找到了一种解决方法,他们开发了一种特殊设计的脂质纳米颗粒,可以将免疫触发分子携带到肝脏中的免疫细胞巨噬细胞中。
这种脂质被称为YSK12-C4,对免疫细胞.当静脉注射到小鼠体内时转移性黑色素瘤他们能够通过肝巨噬细胞的细胞膜传递信号分子,称为环二核苷酸,在那里他们通过干扰素基因刺激器(STING)途径刺激称为1型干扰素的免疫相关蛋白的产生。这些物质被释放到血液中,激活了另一种叫做自然杀伤细胞在脾脏和肺部,其中产生的干扰素γ肺内转移。
-
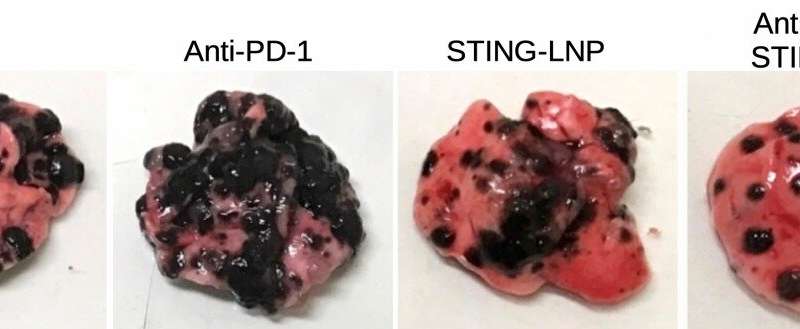
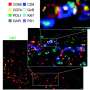
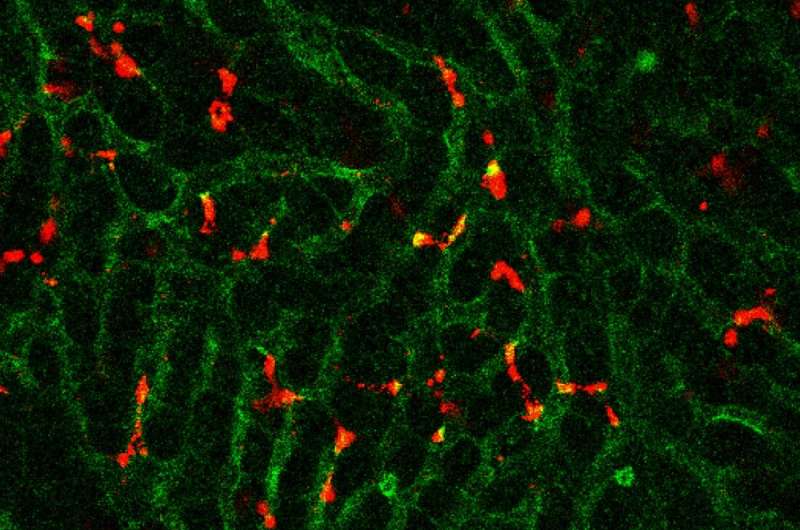
抗pd -1耐药肺癌的联合治疗。抗pd -1抗体和干扰素基因刺激剂(STING)负载脂质纳米颗粒(STING- lnp)的组合在减少肺部转移(黑色区域)(粉红色组织;右)。sting -脂质纳米颗粒单独的效果(中右)比抗pd -1抗体(中左)更好,其效果与对照盐水溶液(最左)相同。来源:Takashi Nakamura, et al。癌症免疫治疗杂志。2021年7月2日 -
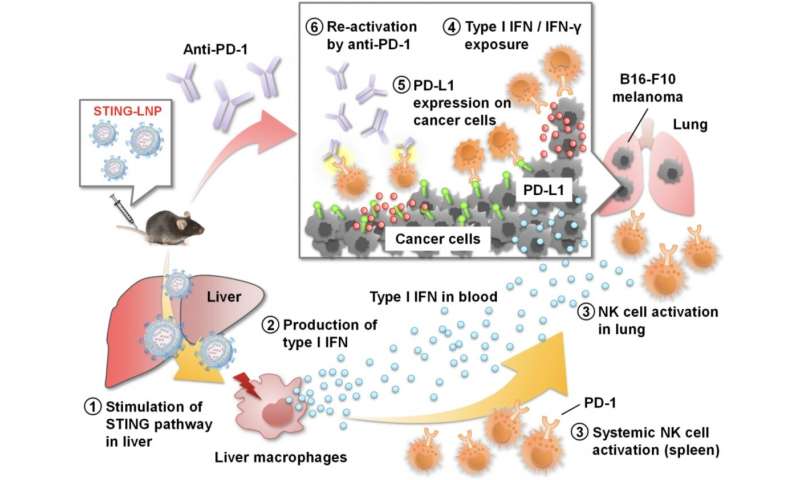
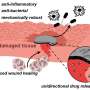
STING-LNP降低pd -1抗性的研究综述。STING-LNPs被静脉注射到小鼠体内,将免疫信号分子传递到肝脏。这刺激了肝脏巨噬细胞产生IFN-1,进而激活了肺和脾脏中的NK细胞。NK细胞的作用受PD-L1的限制;当STING-LNPs与Anti-PD-1治疗联合使用时,NK细胞能够充分发挥作用并摧毁癌细胞。干扰素干扰素;朝鲜,自然杀手;PD-1,程序性细胞死亡1;STING-LNP,含干扰素基因刺激剂的脂质纳米颗粒。来源:Takashi Nakamura, et al。 Journal for ImmunoTherapy of Cancer. July 2, 2021
这种治疗本身只产生了轻微的抗肿瘤作用。这是因为1型干扰素和干扰素γ触发了一种叫做PD-L1的蛋白质的表达癌症细胞。PD-L1阻止强杀伤肿瘤免疫反应表达PD-1的自然杀伤细胞。然而,使用抗pd -1免疫疗法可以阻止癌细胞关闭这些自然杀手细胞随后武装起来,能够发动全面攻击。
北海道大学药学院的中村高志说:“研究结果表明,我们携带免疫信号分子的脂质纳米颗粒将免疫状态从免疫冷转变为免疫热。”“这可能会导致一种有前途的佐剂的发展,减少一些癌症患者对抗pd -1抗体治疗的耐药性。”
进一步的研究将需要检查治疗是否会导致肝毒性,以及是否可以使用不同的信号分子。
进一步探索