FDA批准罗氏药物治疗非小细胞肺癌

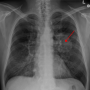
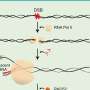
罗氏公司在一份声明中表示,美国食品和药物管理局(fda)已批准罗氏公司的Tecentriq作为手术和铂基化疗后的辅助治疗,用于经fda批准的测试确定的II-IIIA期非小细胞肺癌。
此次批准是基于IMpower010 III期研究的中期分析结果。
结果显示,随后使用Tecentriq或atezolizumab治疗手术与最佳支持治疗相比,与铂基化疗相比,II-IIIA期非小细胞肺癌患者的疾病复发或死亡风险降低了34%。
Tecentriq此前在各种类型的肺癌中显示出有临床意义的益处,目前在美国有六种已批准的适应症
除了成为第一个被批准用于辅助治疗非小细胞肺癌的癌症免疫疗法外,tecentrq也是第一个被批准联合卡铂和依托泊苷(化疗)一线治疗成人广泛期小细胞肺癌的癌症免疫疗法。
Tecentriq也有4个已批准的高级非小细胞肺癌作为单一药物或与靶向治疗和/或化疗联合使用。
Tecentriq有三种给药方式可供选择,每两周、三周或四周可灵活选择给药。
进一步探索
©2021 dpa GmbH。
由论坛内容代理有限责任公司分发。