抑制极光激酶蛋白可能有助于克服抵抗喀斯特抑制肺癌
在临床前模型,结合一个临床实验的极光激酶(AURKA)抑制剂与喀斯特抑制剂或WEE1抑制剂显示功效对肺癌细胞内在或获得性耐药喀斯特抑制,根据结果提出AACR-NCI-EORTC虚拟国际会议的分子靶和癌症治疗,2021年10月7日,举行。
“KRAS-mutated肺癌,占大约30%的肺癌,是一个很难治疗的恶性肿瘤,”李主持人Jong Woo说,博士,耶鲁大学的科学家在医学肿瘤癌症中心。“虽然抑制剂KRASG12C一直被视为一项重大突破,阻力可以通过自适应信号机制,迅速发展导致突变喀斯特的复活,”李说。第一个喀斯特抑制剂,sotorasib (Lumakras)被批准临床使用由美国食品和药物管理局今年早些时候。
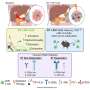
AURKA是喀斯特,放大的效应蛋白下游RAS信号也参与调节细胞分裂。先前的研究已经涉及AURKA激活抗喀斯特抑制和建议AURKA超表达与RAS信号增加,大KRAS-driven瘤形成,和不良预后。此外,李和同事先前的研究表明,抑制细胞周期检查点蛋白质WEE1主体性与AURKA抑制诱导细胞死亡。
“根据这些观测,我们探索AURKA抑制的潜力,结合WEE1或喀斯特抑制,作为治疗的设置内在或获得性耐药sotorasib,”李说。
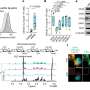
在这项研究中,李和他的同事们评价试验的功效AURKA抑制剂维克- 1911结合sotorasib KRASG12C-mutated肺癌细胞在固有电阻sotorasib;他们还评估维克- 1911结合临床实验WEE1抑制剂adavosertib KRASG12C-mutated肺癌细胞sotorasib获得性耐药。
他们发现的维克- 1911 sotorasib导致增加细胞死亡防sotorasib癌细胞同样的待遇相比sotorasib敏感的癌细胞,这表明AURKA抑制可能有助于克服sotorasib阻力,李解释道。此外,结合抑制AURKA和WEE1导致协同增加KRAS-mutated肺癌的死亡细胞与获得性耐药sotorasib以及协同肿瘤控制在喀斯特/ TP53-mutated肺癌异种移植模型。
“我们的研究结果表明,AURKA激活可能导致内在和获得性耐药在KRAS-mutated sotorasib肺癌细胞,抑制AURKA可能在此设置一个有前途的治疗方法,”李说。“基于这些发现,我们相信维克- 1911和维克- 1911的组合与sotorasib或adavosertib KRASG12C-mutated肺癌患者应进行抗KRASG12C抑制剂。”
“是至关重要的为这种类型的肺癌患者提供一种新的治疗选择,”资深作者芭芭拉Burtness说,医学研究的共同发展疗法在耶鲁大学癌症研究中心的研究项目。“我们希望这项研究可以为治疗方法提供了一个概念在港口内在和/或获得性耐药的患者KRASG12C抑制剂包括sotorasib。”
李和他的同事们有兴趣探索AURKA的能力抑制防止或推迟获得抗病性sotorasib在临床前模型和在临床设置。
这项研究的一个限制是,所有实验进行临床前模型的肺癌症;进一步确认patient-derived异种移植模型和在临床试验中需要了解治疗的病人的疗效。