旅行“内部”COVID-19病毒蛋白质攻击弱点
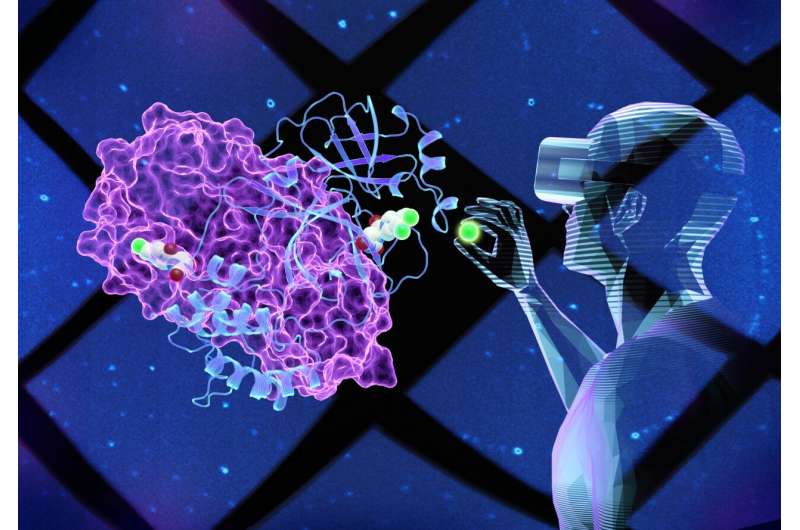
虚拟现实(VR)技术使科学家创建对象的三维模型,然后几乎“内部”去看看,以便更好地理解它的结构和功能。
这是研究人员在美国能源部(DOE)的橡树岭国家实验室(ORNL)研究导致COVID-19 SARS-CoV-2病毒大流行。该团队使用x射线和中子图的一部分内部结构的冠状病毒创建一个精确的3 d模型。具体地说,科学家们绘制了主要蛋白酶(Mpro),一个酶参与病毒复制,添加了一个初步的小分子发现了使用高速电脑筛选。
使用虚拟现实看酶模型,科学家们几乎构造不同的小分子通过修改其结构是否可以适应任何新设计的化合物,或绑定一个关键站点Mpro酶表面。足够强大约束力可以抑制或阻止酶的功能,这是至关重要的阻止病毒繁殖COVID-19患者。
确定具体的化学修改的影响如何紧密19 Mpro酶抑制剂候选人绑定,每个团队合成抑制剂分子和测量他们的绑定的优点。较强的约束力,更有效的抑制剂会阻止酶功能和病毒的复制。
测试抑制剂之一,标记hl - 3 - 68,显示出优越的结合能力和抑制Mpro相比其他的功能进行了测试。的细节研究,题为“结构、电子和静电因素抑制剂结合子站在SARS-CoV-2主要S1和S2蛋白酶”,发表在《医药化学杂志。
“我们的研究是为了更好地了解分子Mpro酶的活性部位结合,在SARS-CoV-2复制中起着关键作用,”主要作者丹尼尔·科内尔说。“在测试的过程中我们设计的分子,我们发现了一个包含一个额外的氯原子抑制Mpro显示更大的能力。这部小说化学结构不同于之前所研究的全球社区,可以开辟新的途径研究打击SARS-CoV-2激动人心的可能性。”
Mpro酶的活性部位是常见的其他类型的冠状病毒和看起来并不容易mutate-presenting可能设计一个抗病毒治疗的机会,对多个SARS-CoV-2变异和其他冠状病毒。
同样重要的是,活跃的网站不同于那些已知的人类酶,从而减少潜在的意想不到的绑定,可能导致副作用的病人。
Mpro酶样品的x射线测量和生产进行了结构和分子生物学中心使用设施ORNL的散裂中子源(SNS)和资源的高通量同位素反应堆(HFIR)。抑制剂候选人被李合作者回族和彼得Bonnesen合成高分子纳米材料的纳米材料科学中心(CNMS)。
“这项研究结合大量的生物物理、生物化学和分子生物学方法,包括虚拟reality-assisted结构分析和小分子构建、汇集科学家来自ORNL,阿贡国家实验室,美国国立卫生研究院,和Tennessee-Knoxville大学的。合作性质的研究让我们发现小分子抑制剂时必须遵守规则绑定到酶为了是有用的进一步措施长期药物设计和开发的过程,”该研究的通讯作者安德烈Kovalevsky。
共同通讯作者彼得Bonnesen补充道,“这是一个新的和令人兴奋的项目CNMS,它利用我们的专业知识为我们的用户定制合成有机分子。对于这个项目,我们提供了SNS的同事一次与几个候选分子。结果回来有关分子的有效性作为抑制剂,研究小组将讨论调整使分子结构。然后回族,我将回到实验室,使这些新候选人抑制剂。”
研究还揭示Mpro酶的能力改变其形状和改变其从正到负的电荷,或从消极到积极的大小和结构抑制剂分子结合。这些特性是重要的理解在开发一个有效的抑制剂分子。
中子散射的研究中,科学家们使用了大分子中子衍射仪(曼迪)SNS的收集数据的能力相对较小的样本团队一起工作。
“由于相关研究的紧迫性质SARS-CoV-2病毒,我们只能够成长Mpro酶的相对较小的样本,”合著者科茨雷顿说。”小样品散射中子弱,这导致“嘈杂”中子数据,数据分析是很困难的。曼迪的中子束的时间结构工具允许我们移除大部分的噪声,从而提高信噪比,给我们更多有用的数据。”
下一步ORNL人员包括测试的化学修改的hl - 3 - 68缓蚀剂,以确定是否有任何新设计的化合物可以绑定甚至比hl - 3 - 68更有效地抑制Mpro酶,最终防止冠状病毒复制。
与此同时,研究人员让他们的数据公开通过蛋白质数据银行加快通知和协助世界科学和医学的社区。当然,更多的研究是必要的验证和测试的有效性和安全性作为COVID-19抑制剂治疗。然而,这项研究可能提供了一个机会为其他科学家进行额外的研究,将有利于全世界数十亿人。
论文的其他合作者包括Stephanie Galanie Gwyndalyn菲利普斯奥黛丽拉贝风,凯文·l·韦斯秋张,马克·a·阿诺德)奥斯汀克莱德,亨,Arvind拉马纳坦,科琳琼森,玛莎s头,约翰•m•路易斯。休·奥尼尔从ORNL样品制备过程中协助。
进一步探索