慢性肠炎如何引起癌症

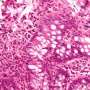
慢性炎症性肠病(IBD)是胃肠道的炎症,该胃肠道的炎症分为相,并伴有血腥的肠运动,腹泻和生活质量的严重损害。IBD患者表现出发生结直肠癌的风险增加。肠道粘膜细胞(肠上皮)中的DNA受到慢性炎症过程的破坏,这是促进的。在DNA损伤后,健康状态下的细胞可以通过不进一步分裂来保护自身免受缺陷基因组的积累。但是,这些保护机制在炎症条件下被悬浮,这促进了肠癌的发展。尚不理解为什么在慢性炎症的情况下这些保护机制会功能失调。
卓越集群“慢性炎症中的精密医学”(PMI)的团队现已表明,这是IBD的风险基因的基因XBP1对肠粘膜细胞如何处理DNA损伤,从而具有决定性的影响保护自己免受癌症的发展。此外,由Kiel University(CAU)的临床分子生物学研究所(IKMB)的Philip Rosenstiel教授和PD教授Konrad Aden博士领导的团队和Kiel校园的Schleswig-Holstein(UKSH)的团队。找到可能的潜在机制的初始迹象。他们在科学杂志上发表了结果胃肠病学。
风险基因恶化DNA修复
在健康的,不变的状态下,XBP1的基因编码蛋白,可确保肠粘膜的分子平衡并防止炎症。在IBD患者中,该基因在肠道中失去功能会导致障碍和不受阻碍的炎症。在新发布的研究中,基尔研究小组表明,该基因也可以在肠癌的出现中发挥作用。如果在肠粘膜的表面细胞中缺少该基因,则不再正确执行遗传物质的重要修复机制。第一作者Lina Welz报道:“如果肠上皮细胞中缺少IBD风险基因XBP1,那么DNA损伤和细胞分裂将发生。PMI卓越群正在IKMB进行博士研究,同时在Kiel Campus Kiel UKSH的内科I部完成她的专业医学培训。
通过肿瘤抑制剂p53和MTOR信号通路的机制
在下一步中,研究人员想准确了解XBP1基因用于调节DNA修复的哪种机制,因此在XBP1功具有癌症。研究人员发现了已经众所周知的分子开关P53(一种所谓的肿瘤抑制剂)的重要作用,可保护细胞免受恶性变性。p53被认为是“基因组的监护人”,在控制细胞生长中起着决定性的作用。研究小组能够证明XBP1协调p53肿瘤抑制器的活性。他们还设法确定了一种新机制肿瘤抑制p53禁止肠上皮的不受控制的生长细胞。“我们的结果表明,XBP1和p53通过所谓的MTOR信号传导途径共同起作用,以防止受损的肠道上皮细胞受到不受控制的增殖,从而变得恶性,” PD高级作者Konrad Dr. Konrad Dr.在卓越的PMI群和内科医学系的高级医师在Kiel校园UKSH。
潜在的治疗方法
在医学上,MTOR信号通路长期以来一直用作其他疾病的治疗靶标,可以为癌症治疗提供新的早期访问。研究人员用MTOR途径(药理学物质雷帕霉素的特异性抑制剂)治疗了增加DNA损伤和有缺陷的XBP1基因的小鼠和细胞系统。“在我们的模型中,雷帕霉素显着降低了细胞分裂的增加以及对肠上皮,”亚丁报道。
“尽管我们很长一段时间以慢性肠炎引起癌症,但我们对基础过程的了解相对较少。我们的结果现在提供了炎症,干扰细胞分裂和遗传物质修复之间的新联系。”IKMB主任Philip Rosenstiel教授。罗森斯蒂尔说:“因此,我们将在进一步的研究中研究如何使用靶向抑制MTOR信号通路来防止肠道炎症和癌症。”
“该集群临床医生的科学成功也证明了卓越PMI集群临床科学家计划的有效性,该计划使医生能够与他们的专业医学培训同时进行研究。以这种方式创建的研究和良好的科学基础设施使诸如莉娜·韦尔茨(Lina Welz)等临床活跃的医生能够取得如此杰出的科学成就,” PMI发言人,IKMB,CAU和UKSH主任Stefan Schreiber教授以及该部门主任Kiel校园UKSH的内科I。