常见的基因变异与脓毒症和COVID-19严重性在非洲裔美国人
两个遗传风险变异由近40%的黑人个体可能会加剧脓毒症的严重程度和COVID-19,宾夕法尼亚大学的一个研究小组从佩雷尔曼医学院的发现。研究结果,发表在免疫力,确定两个潜在途径减少健康差异由这些基因突变。
“我们的发现表明,APOL1风险变异可以解释一个重要种族差异中观察到脓毒症黑人个体之间的发生率和严重程度。此外,我们的工作意味着对象的识别高危APOL1基因型可能是重要的疾病风险预测和早期干预,”该研究的第一作者说,Katalin Susztak,医学博士,博士,教授在佩恩Renal-Electrolyte和高血压。
每年,至少170万名成年人在美国开发一个败血症感染,导致近270000人死亡。在美国非洲血统的,病人有严重脓毒症住院率高67%,增加20%的可能性死于条件相比,白色的个人,即使co-variates调整。同样,COVID-19不成比例地影响了非洲裔美国人,高感染率和更严重的疾病。
两个基因的变异APOL1-G1 G2-are发现几乎只在西部非洲血统的人。携带一个风险等位基因赋予抵抗非洲昏睡病,同时有两个风险等位基因显著增加患慢性肾病的风险,以及艾滋病毒和COVID——诱导肾小球疾病,已Susztak最近研究的实验室。
确定APOL1风险变异可能导致黑人和白人之间的差距在脓毒症严重程度患者,宾夕法尼亚大学医学研究者分析了百万资深放行。国家生物基因组数据,包括超过840000名退伍军人。
研究者评估协会APOL1风险变异与脓毒症的发病率在57000名黑人参与者,发现有显著相关性的基因变异和脓毒症发生率在这个人口。
类似于败血症,COVID-19与严重的炎症有关,肾功能衰竭,严重的血管变化。研究小组获得等离子体样本74 COVID-19患者住院宾夕法尼亚大学的再发现有患者APOL1变异之间的联系和更高的COVID-19严重性。
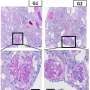
为了测试这种相关性的强度,生成新的小鼠模型,研究团队把G2相比风险等位基因和他们控制,没有携带变体。研究显示,老鼠表达风险等位基因经验丰富的血管炎症,泄漏,更严重的败血症。单细胞测序和体内实验证明risk-variant等位基因的表达也导致线粒体损伤,导致线粒体DNA的胞质释放。
最后,研究小组测试这些结果是否可以预防,发现抑制两种途径(inflammasome和刺痛)转基因小鼠保护缺陷引起的风险变体。有几个新的有前景的药物正在开发目标APOL1,和宾夕法尼亚大学团队的结果表明基因研究可以提供关键信息在治疗严重脓毒症和COVID-19精确治疗。
更多信息:吴Junnan et al, APOL1风险变异个体的非洲遗传祖先驱动内皮细胞缺陷加剧脓毒症,免疫力(2021)。DOI: 10.1016 / j.immuni.2021.10.004