FDA的监管松懈的研究在发展中国家可以做伤害脆弱的参与者
美国食品和药物管理局提供更严格的监管在决定是否批准使用的海外研究试验药物比在国内进行的。这是找到的我最近的研究发表在《临床药理学杂志》上。
我的研究机构的监管过程中突显出漏洞,利用弱势群体为药物的批准决定,导致错误的数据。直到2000年代初,参与者在FDA-reviewed研究试用几乎全部来自美国,但2010年的一份报告发现,卫生和人类服务78%的研究参与者为海外。更快的研究课题招聘和更低的与这些监管loopholes-seem expenses-paired推动这种转变。
尚不清楚多久这些漏洞允许有问题的试验通过系统,因为试验出错不可以透露,还有几乎没有现场检查。
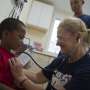
在一个例子中,一个基于2001试验在印度允许使用安慰剂控制在严重精神疾病患者有有效的替代疗法。在另一个印度的试验中,患者不真实地告知他们药物治疗躁狂是不再可用他们只能得到一个实验药物或安慰剂。一些患者甚至不知道他们是在一个审判。
在我2020年发表的一项研究中,我提到了印度审判执行心电图申请多个人后来发现是欺骗性的副本从单个的人。我也在大规模的数据操作的一个例子来自汉语学习网站来做一个实验药物看起来比实际上更有效。
批准药物的数量,但后来不得不撤回或有新的不良事件增加了严重警告21每100药物在2012年之前27 100药物之后。这伴随着戏剧性转向海外临床试验用于FDA药品批准。
之前,研究人员就可以开始实验药物人体试验研究对象在美国本土,公司必须提交”临床实验的新药美国食品和药物管理局”应用程序。这些应用程序描述他们和所有的试验进行实验室测试计划执行美国公民。FDA可以阻止不道德的审判开始在美国由于其权威1887年州际贸易法案但只是因为实验药物跨越州界。
但是一个为海外研究漏洞存在,因为实验药物不需要跨越美国州界。这意味着公司可以开始海外研究试验之前,美国食品和药物管理局评估药物的应用程序,他们没有透露他们打算执行的所有研究。
得到一种实验性药物获得FDA批准,公司必须提交一份新药物的应用程序该机构。研究试验以前向FDA提出,公司必须包括所有的试验数据。然而,当试验进行海外FDA不知道,企业可以择优挑选支持试验,省去那些负面的结果。因此,FDA可能没有一个完整的药物的潜在益处和不良事件在决定是否应该批准。
自1990年代以来,FDA已经越来越多地由用户的费用从它所监管的企业。这些费用包含许多FDA的成本函数,包括产品批准和生产设施检查。他们支付的制药、生物技术和设备公司以及仿制药制造商。最初引入加快用户费用药物审批过程在艾滋病毒/艾滋病的早期艾滋病毒药物。
这些用户费用协商FDA和企业之间,然后被国会批准。2022年,新谈判费用将五年生效。在过去的谈判,2017年FDA提出费用基金审判现场检查在发展中国家,但这些公司拒绝了。因此,国外临床试验网站27倍不太可能被FDA检查比在美国