研究人员确定了导致运动神经元疾病ALS神经破坏的生物机制
特拉维夫大学萨克勒医学院和萨格尔神经科学学院的一个研究小组首次发现了神经退行性疾病ALS引起神经破坏的生物机制。这项开创性的研究由Eran Perlson教授和博士生Topaz Altman和Ariel Ionescu领导,研究表明,这种致命疾病的病程可以延缓,甚至在早期阶段就可以逆转。这项研究是与希巴医疗中心神经肌肉疾病诊所主任阿米尔·多里博士合作进行的。研究结果发表在自然通讯.
ALS是最常见的一种电动机神经疾病,导致瘫痪和肌肉萎缩。每400人中就有一人患有这种疾病,但目前还没有有效的治疗方法。渐冻症患者会逐渐失去控制随意肌肉运动的能力,导致完全瘫痪,最终失去独立呼吸的能力。目前,ALS患者的平均寿命只有3年左右。
Perlson教授解释说:“到目前为止,还不清楚是什么原因导致了这种疾病。”“只有大约10%的患者携带已知基因突变的家族背景,但其余90%是一个谜。该病引起的瘫痪是由于运动神经元受损,导致神经末梢变性和肌肉神经支配丧失。结果导致神经退化和脑内运动神经元死亡脊髓然而,到目前为止,我们还不能理解造成这种恶性瀑布背后最初损害的基本生物学机制。”

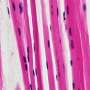
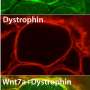
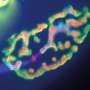
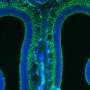
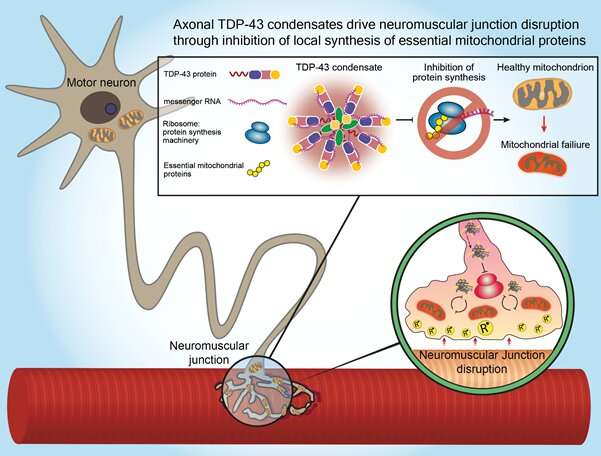
为了解开这个谜团,特拉维夫大学的研究人员专注于一种名为TDP-43的蛋白质,在早期的研究中,这种蛋白质在大约95%的ALS患者的大脑中以不寻常的数量积累和定位。帕尔森教授和他的团队揭示了这种蛋白质的积累与运动神经元末梢和肌肉之间的突触退化之间的一种新的生物学联系,这种突触被称为神经肌肉连接,它将神经指令转化为物理动作。在渐冻症患者的肌肉活检中,研究人员发现,在疾病早期和患者出现任何严重症状之前,有毒蛋白质也会在这些神经肌肉连接处高度接近的地方积聚。在研究人员对渐冻症患者的细胞和转基因模型动物进行的一系列实验中,他们发现TDP-43蛋白在神经肌肉连接处的积累抑制了局部合成蛋白质的能力,这些蛋白质对线粒体活动至关重要,而线粒体活动为基本的细胞过程提供了力量。神经末梢线粒体功能障碍导致神经肌肉连接中断,最终导致运动神经元死亡。“重要的是首先要理解运动神经元的空间复杂性,”Perlson教授说。
“运动神经元存在于脊髓中,需要到达身体的每一块肌肉才能操作它。例如,我们可以想象,一根延长线从脊髓中伸出,到达我们脚上小脚趾的肌肉。这些延伸在成年人身上可以长达一米,被称为轴突。在早期的研究中,我们已经表明,要维持这种复杂的组织,运动神经元轴突需要更多的能量,特别是在最偏远的部分,神经肌肉连接。在我们目前的研究中,我们专注于发生在这些轴突和神经肌肉连接处的TDP-43蛋白的病理变化。在正常的运动神经元中,这种蛋白质主要存在于细胞核中。我们发现,在肌萎缩性侧索硬化症中,这种蛋白质从细胞核中释放出来,并在整个细胞中聚集,特别是在神经肌肉连接处。由于运动神经元的功能依赖于这些位于“延长线”远端的神经肌肉连接,我们意识到这一发现可能至关重要。我们发现TDP-43蛋白在神经肌肉连接处形成的堆积会捕获RNA分子,并阻止线粒体功能必需蛋白质的合成。线粒体是细胞中的细胞器,是包括神经传输在内的许多细胞过程的主要能量提供者。 The condensation of TDP-43 protein in neuromuscular junctions results in a severe energy depletion, prevents mitochondrial repair, and consequently leads to the disruption of these junctions, degeneration of the entire 'extension cable' and to the death of运动神经元在脊髓里。”
为了证实他们的发现,特拉维夫大学的研究人员决定使用一组来自美国的研究人员最近发表的一种实验性分子,该分子是为了另一个目的而开发的——通过分解神经延伸中的蛋白质冷凝物来增强损伤后的神经再生。研究人员证明,这种分子还可以分解ALS患者细胞中的轴突TDP-43蛋白冷凝物,这一过程提高了产生必需蛋白质的能力,增强了线粒体活性,并防止了神经肌肉连接处变性。此外,在模型动物中,研究人员表明,通过逆转神经和神经肌肉连接处的TDP-43积累,可以恢复退化的神经肌肉连接处,并几乎完全恢复患病的模型动物。

“当我们诱导TDP-43蛋白冷凝物的分解时,神经产生蛋白质的能力得到恢复,特别是对线粒体活动至关重要的蛋白质的合成。所有这些都使神经再生成为可能”,帕尔森教授总结道。“我们能够通过药理学和遗传学手段证明,运动神经可以再生,患者可以抱有希望。事实上,我们找到了基本的机制,以及导致肌肉神经断裂和神经退化的蛋白质。这一发现可能会导致新的治疗方法的发展,可以溶解TDP-43蛋白质凝聚或增加对线粒体功能至关重要的蛋白质的产生,从而在脊髓发生不可逆损伤之前治愈神经细胞。我们正在另一端解决问题神经肌肉接头.如果未来我们能够及早诊断和干预,也许就有可能抑制渐冻症患者肌肉的破坏性退化。”
这项研究与来自德国、法国、英国和美国的顶尖科学家进行了国际合作,并得到了Perlson教授实验室的Tal Gardus Perry和Amjad Ibraheem的协助。