发现了如何脑细胞死在朊病毒疾病
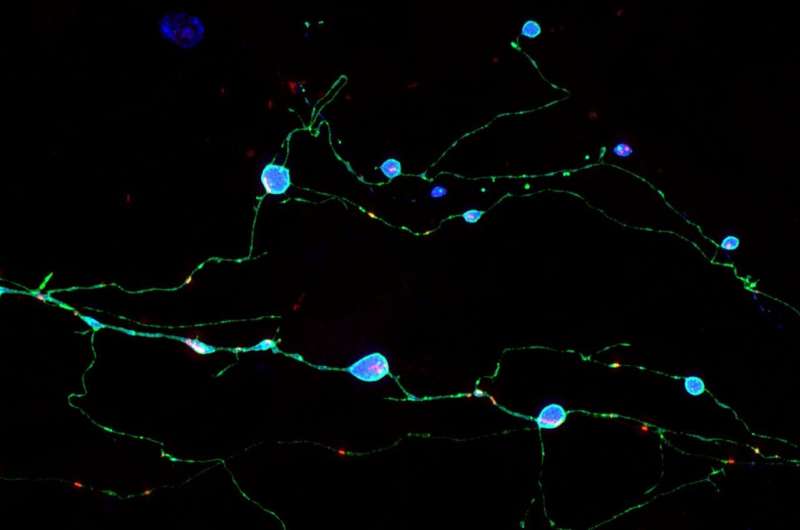
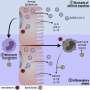
朊病毒疾病,如克雅氏病(CJD),快速移动,致命的痴呆综合征与骨料的朊蛋白的形成,PrP。如何这些聚合形成并杀死脑细胞内从未完全理解,但斯克里普斯研究所的科学家的一项最新研究表明,聚合杀死神经元损害了他们的轴突,狭窄的神经纤维通过发送信号到其他神经元。
蛋白质总量的积累轴突以及轴突肿胀和其他障碍的迹象,也是其他神经退行性疾病的早期特征包括阿尔茨海默病和帕金森疾病。如何将这些发现朊病毒聚集在轴突形成以及如何抑制它们,报道科学的进步可能最终有意义,远远超出了朊病毒疾病。
“我们希望这些发现将导致更好的理解朊病毒和其他神经退行性疾病,以及新的治疗策略,”说研究高级作者Sandra Encalada博士,阿琳和阿诺德·戈尔茨坦在分子医学系副教授斯克里普斯研究。
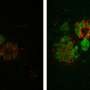
研究人员在他们的研究密切观察突变,致病朊病毒蛋白质的副本PrP在神经元的轴突形成大骨料,但不是主要神经元的细胞体。这些聚合物的形成之后,轴突障碍并最终神经元死亡的迹象。科学家们发现的证据表明,神经元的废物处理过程通常能够应付这样聚集在或接近时神经元的主要细胞,但不太能做当总量积累在轴突。
研究人员还发现了一个复杂的关键蛋白质是负责指导PrP到轴突,导致聚合与大轴突肿胀。他们证明了沉默中的任何一个这些蛋白可以抑制聚合物的形成和保护神经元免受伤害和死亡。
脆弱的轴突
库贾氏症是最常见的人类朊病毒疾病,发生在一种情况下的速度每年每百万人口。大多数情况下被认为是自发产生的,当PrP在某种程度上改变了大脑,开始聚集。因为这些总量增长了一个连锁反应的过程,画在健康PrP的副本,他们可以传输库贾氏症在罕见的情况下——例如,在角膜移植外科一个人到另一个地方。大约15%的病例是世袭的,引起的突变,使PrP更容易聚合。朊病毒疾病发生在其他哺乳动物和被认为是由于类似有毒聚合不同物种的PrP蛋白质。
在这项研究中,Encalada包含突变PrP的团队利用老鼠大脑细胞,以及微电影的技术,研究了初始积累PrP聚集在轴突。一个神经元的轴突常常是很长时间与它的主要身体soma和被发现是弱势群体为运输中断的微妙的系统基本分子和消除浪费。
PrP的普通神经元功能尚不清楚,但蛋白质似乎通常分泌,通过sac-like容器称为囊泡,soma和轴突,有时返回被回收或退化的浪费。研究人员在他们的实验中发现,突变体PrP在soma还生产主要封装在囊泡,搬到轴突沿铁路称为微管。
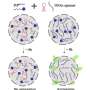
这个运动涉及到一个有点复杂的泡交易系统,研究人员观察到,这个系统分流术的PrP远到轴突,PrP-containing囊泡聚集和合并。突变PrP在这种情况下形成大型aggregates-Encalada称之为endoggresomes-that轴突不能摆脱。聚集导致轴突肿胀,和其他功能障碍的迹象,包括减少神经元钙信号,并最终更快神经元相比死亡率与正常的PrP神经元。
研究人员还发现一种对抗endoggresomes形成。他们鉴定出四种蛋白质,Arl8、kinesin-1 Vps41,跳过,负责指导PrP-containing囊泡到轴突,载着他们到soma,并合并它们与其他PrP-containing引发聚合形成囊泡。沉默时这些蛋白质,更少PrP-containing囊泡进入轴突,轴突显示很少或根本没有聚合的迹象,和神经元或几乎正常运行正常,幸存下来一样正常的脑细胞。
结果指向诱人的可能性朊病毒疾病,或许其他许多蛋白质总疾病的大脑,可以预防或治疗中断至少是暂时性的贩运过程带来vesicle-encapsulated, aggregate-prone蛋白质到轴突。
“我们非常热衷于发现分子可以抑制这种aggregate-forming途径和研究这类抑制剂的影响在朊病毒和其他的动物模型神经退行性疾病”,Encalada说。
“Endosomal排序驱动轴突的形成朊病毒蛋白质Endoggresomes”是由罗曼Chassefeyre,大Chaiamarit Adriaan Verhelle,安德烈Leitao和桑德拉Encalada,所有的斯克里普斯研究;和萨米Weiser诺瓦克,莱昂纳多安德拉德和Uri庄园,索尔克生物研究所。
进一步探索