研究人员利用基于干细胞的研究工具识别潜在的AMD药物
利用干细胞衍生模型,研究人员已经确定了两种可能减缓干性老年性黄斑变性(AMD)的候选药物,AMD是导致失明的主要原因,目前尚无治疗方法。来自美国国立卫生研究院下属国家眼科研究所(NEI)的科学家们今天在《美国医学杂志》上发表了他们的研究结果自然通讯。
“这种干性AMD的干细胞衍生模型是游戏规则的改变者。科学家们一直在努力解开这种极其复杂的疾病,而这个模型可能被证明对理解AMD的原因和发现新的治疗方法是非常宝贵的,”NEI主任Michael F. Chiang医学博士说。
这是第一批表明有可能开发一种基于盘子的模型,它可以复制复杂疾病的特征(表型),而不是由单一突变引起的疾病。AMD的病因包括遗传因素、衰老和行为相关的风险因素(如吸烟和饮食),这些因素的组合尚不清楚。
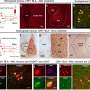
研究人员使用该模型筛选药物,以观察它们是否可以减缓或阻止疾病进展。两种药物阻止了模型产生关键表型:drusen的积累,视网膜中富含脂质的沉积,以及视网膜色素上皮细胞(RPE)的萎缩或收缩。RPE是滋养视网膜感光细胞的一层组织。在AMD中,RPE细胞收缩和死亡。RPE的丧失导致光感受器的死亡,进而导致视力的丧失。
在NEI眼科和干细胞转化研究部门的Kapil Bharti博士和实验室的工作人员、论文的主要作者Ruchi Sharma博士的带领下,研究人员使用干细胞来源的成熟RPE细胞开发了该模型。Bharti的团队最初利用AMD患者捐献的皮肤成纤维细胞或血液样本开发了这种细胞。在Bharti的实验室中,成纤维细胞或血细胞被编程为诱导多能干细胞(iPSC),然后再次编程为RPE细胞。
重要的是,这些发现揭示了遗传变异如何影响AMD的发展。
先前的遗传学研究表明,一些AMD患者负责调节替代补体途径的基因存在变异,补体途径是免疫系统的关键部分。然而,目前尚不清楚这些基因变异是如何导致疾病的。
一种假设是,具有这种变异的患者缺乏调节替代补体通路的能力,一旦补体通路被激活,就会导致过敏性毒素(一种介导炎症的蛋白质)的形成,以及其他生物功能。
为了验证这一假设,研究人员将10个ipsc来源的RPE细胞系暴露于人血清中的过敏性毒素,这些细胞系涉及不同的遗传变异。他们预测,这种压力挑战可以替代在AMD患者眼中观察到的年龄诱导的补体交替通路的增加。
暴露于激活的人血清的ipsc衍生的RPE产生了关键的疾病表型:drusen的形成和RPE萎缩,这与疾病的晚期有关。虽然在研究中使用的所有10种ipsc来源的RPE细胞中都出现了疾病进展的迹象,但与具有低风险变体的患者相比,来自替代补体途径中高风险变体的ipsc来源的RPE更糟糕,这为研究人员提供了一种识别基因型对疾病特征的具体影响的方法。
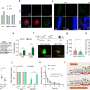
利用这个模型,他们从一个药理学药物库中筛选了1200多种药物,这些药物已经针对一系列其他疾病进行了测试。
该筛选标记了两种能够抑制RPE萎缩和drusen形成的药物:一种称为氨基戊酸的蛋白酶抑制剂,它可能直接阻断细胞外的补体通路,另一种药物(L745)通过失活多巴胺通路间接阻止细胞内补体诱导的炎症。
巴蒂说,在这两种基因中,L745看起来最有前途,在生物学上也很有趣。该药由默克公司(Merck & Co.)开发,最初用于治疗精神分裂症。
作为当前工作的延伸,Bharti实验室帮助从NEI支持的大型参与者中生成了iPSCs临床研究被称为AREDS2。
“我们增加了65条ipsc衍生的RPE生产线,现在它们正在与研究社区为AMD的研究创造模型。”“这篇论文提供了一个开发此类模型的框架,因此对AMD研究社区具有广泛的影响。”
AREDS2 ipsc衍生的RPE细胞可以通过纽约干细胞基金会管理的储存库获得。
更多信息:Ruchi Sharma等,上皮表型恢复药物抑制iPSC模型中的黄斑变性表型,自然通讯(2021)。DOI: 10.1038 / s41467 - 021 - 27488 - x