2021年12月14日功能
科学家们在一种主要折磨年轻人的遗传性心脏疾病中发现了额外的分子错误

一项涉及毁灭性的遗传性心脏病的新研究表明,粘附蛋白(支持心脏的分子)的突变显然在破坏器官最外层的完整性方面发挥了作用,使患者容易发生心脏性猝死。
心外膜心心脏的外层包裹着心肌——收缩肌肉——器官的最内层和最厚的层。
心律失常性心肌病(acm)是一种以室性心律失常为特征的心脏疾病,通常始于青春期或成年早期。心律失常是指心跳不规律,可能过快或过慢。心律失常的发生是因为心脏的电脉冲不能正常工作,对于那些患有ACM的人来说,这种情况增加了致命心律失常的风险。
但ACM是隐蔽和潜伏的,产生很少明显的症状,许多患者除了心悸或晕厥法术。对于其他人来说,ACM的第一个证据是猝死。当年轻运动员在篮球场上或足球场上突然死亡时,死因通常是ACM。
虽然很久以前的研究揭示了这种情况是由遗传造成的,男性比女性的风险更大,但直到现在,科学家们才开始揭示涉及粘附蛋白的特定遗传缺陷是如何被设计成粘附的分子粘合剂心脏细胞一起——反而破坏心脏。
ACM的最新研究来自于荷兰的一系列优雅的研究,这些研究不仅对这种疾病的遗传学提供了新的见解,而且为定制治疗提供了可能的途径。
Drs。位于乌得勒支的荷兰皇家艺术与科学学院于布莱希特研究所的Arwa Kohela和Eva van Rooij说,心脏疾病的起源并不像人们想象的那样。他们已经将这种疾病的遗传起源追溯到连接蛋白的桥粒基因突变,桥粒蛋白在心脏中起支持复合物的作用。一个世纪前,奥地利医生兼科学家约瑟夫·谢弗(Josef Schaffer)从希腊单词bond (desmo)和body (soma)中创造了“desmosome”一词。
桥粒是一种特殊的粘连复合物,具有类似胶水的性质,负责维持组织的机械完整性。作为复合物,桥粒由多种蛋白质组成,其中许多蛋白质在ACM中含有有害的突变。对于患有这种疾病的人来说,表达桥粒的细胞是成纤维细胞(产生结缔组织的细胞)和脂肪沉积物的关键来源。
Hubrecht研究所的科学家们专注于心脏的心外膜,因为它是一个连续的层,它的细胞在一生中都保持增殖和分化为其他细胞类型的能力。心外膜分化依赖于支持蛋白的完整性,尤其是桥粒。由于桥粒和心外膜之间的密切关系,荷兰的这项新研究表明,这种疾病起源于心外膜组织。
Kohela断言:“人类心律失常性心肌病(ACM)的特征是心脏心室中的纤维脂肪沉积,但导致这些沉积的机制尚不清楚,目前ACM的动物模型并不能很好地概括这种表型。科学转化医学.
在胚胎心脏形成的早期,心外膜产生冠状动脉平滑肌细胞和心肌成纤维细胞,它们为发育中的胚胎以及后来完全形成的心脏提供结构支持。支撑蛋白——桥粒的发育是健康心脏不可或缺的组成部分,桥粒来自心外膜组织。
尽管20年前的一项涉及具有独特ACM倾向的希腊人群的研究指出了该疾病的桥粒体突变,但荷兰科学家进一步推进了研究,以澄清为什么珠粒体缺陷会如此严重地阻碍心外膜。事实上,科学家们很惊讶地在心外膜的基因中找到了ACM可能的遗传根源,因为这种疾病的影响主要体现在心肌——心脏的跳动层——通过听诊器可以听到器官发出的经典的“砰砰,砰砰”的声音。
这项研究为更深入地了解ACM打开了一个门户,在美国,每5000人中就有1人患有ACM。在世界其他地区,如意大利北部,患病率达到千分之一。ACM对年轻患者影响深远,在18岁以下的心脏性猝死患者中占10%,在35岁以下的心脏性猝死患者中占17%。
这种疾病的特点是一系列问题,包括伤疤组织和脂肪沉积取代了健康的心肌。心脏累赘的问题还不止于此,因为这种疾病还伴有炎症,最糟糕的是,心脏的普遍退化。
正是由于进行性心肌变性,健康的心脏组织被疤痕组织和脂肪所取代。为了认识到这种疾病的主要特征——心律失常,一些医生把ACM称为“人类已知的最容易引起心律失常的心脏病”。
在进行研究时,Kohela和van Rooij面临着一个特别令人生畏的问题:没有合适的动物模型来研究ACM。实验室啮齿类动物不会产生与人类相同类型的心脏脂肪。
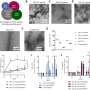
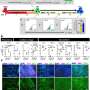
Kohela和他的同事,为了克服缺乏有效的动物模型,从ACM患者身上产生了嗜血小板蛋白-2基因突变的干细胞。嗜血小板蛋白2基因在心肌中表达,在桥粒中发现。含有突变嗜血小板蛋白2基因的细胞分化为心外膜细胞。
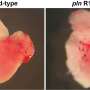
令人惊讶的是,这些心外膜细胞突然自发地进行了纤维脂肪重塑,这种变化与疾病中取代健康心脏组织的纤维和脂肪沉积完全相同。
Kohela写道:“我们使用人类诱导多能干细胞来源的心脏培养、单细胞RNA测序和外植的人类ACM心脏来研究心外膜对ACM纤维脂肪重塑的贡献。”“从ACM患者产生的人诱导多能干细胞显示出自发的纤维脂肪细胞分化,这在等基因对照组中是不存在的。”
单细胞RNA测序和分析,以及对ACM患者心脏组织的检查,进一步揭示了一种被称为TFAP2A的转录因子介导了这种破坏性的心外膜转变。在发现了该因子在ACM中的有害作用后,荷兰团队现在建议阻断TFAP2A可能是有效治疗ACM的一种方法。
该转录因子由TFAP2A基因控制,该基因为该因子(一种蛋白质)的生成提供指令。顾名思义,该因子在介导DNA转录中起着重要作用。转录因子与DNA的特定区域结合,帮助控制细胞分裂和细胞死亡-凋亡。
来自荷兰研究的重要信息:心外膜分化驱动心律失常性心肌病的纤维脂肪重塑。
这项新研究是越来越多的研究的一部分,研究一种影响年轻人的遗传形式的心脏病。尽管这种疾病在20世纪就已经被研究过了,但直到2000年,一项对希腊纳克索斯岛患者的研究结果才帮助科学家确定了第一个致病的ACM突变。研究人员发现,纳克索斯的居民拥有一种罕见的隐性ACM。
哈佛大学的Angeliki Asimaki博士在2014年发表在《儿科心脏病学进展》(Progress in Pediatric Cardiology)杂志上的一份报告中详细叙述了ACM基因研究的大部分历史,并概述了纳克索斯分析的贡献。根据Asimaki及其同事的说法,ACM“是一种桥粒疾病,为识别桥粒基因突变铺平了道路,包括编码纤凝蛋白、嗜血小板蛋白-2、纤凝蛋白-2和纤凝蛋白-2的基因。”
Asimaki及其同事强调:“acm相关突变从受孕开始就存在,但临床表型至少要到青春期或更典型的成年早期才表现出来。因此,在年轻人出现致命心律失常风险之前,及早发现ACM是至关重要的。”
Kohela和荷兰的合作者说,他们的研究已经确定了一种可以被阻断的因素,这为治疗这种疾病提供了一种方法。“虽然还需要进一步的研究,但我们的研究结果表明,抑制TFAP2A可能是治疗ACM的一个靶点,”他们总结道。
©2021科学BOB体育赌博X网络