欧盟监管机构批准辉瑞新冠病毒药物

欧盟药品监管机构周四批准了辉瑞公司的冠状病毒药物,使其成为欧洲首个获批的口服抗病毒药物。
研究表明,这种名为Paxlovid的药物可以降低有感染严重COVID风险的患者的住院率和死亡率,而且可能对Omicron变种有效。
药片被视为终结大流行的潜在巨大一步,因为它们可以在家里服用,而不是在医院。
欧洲药品管理局(EMA)在一份声明中表示:“Paxlovid是欧盟推荐用于治疗COVID-19的第一种口服抗病毒药物。”
美国、加拿大和以色列等少数几个国家已经做出了承诺绿灯辉瑞公司的治疗方案
欧盟委员会现在必须正式批准该药物,但这是一个橡皮图章程序,通常需要数小时或数天。
欧盟卫生专员斯特拉·基里亚基德斯在一份声明中说:“Paxlovid是我们产品组合中第一款家用口服抗病毒药物,有可能对发展为严重COVID的高风险人群产生真正的影响。”
“我们也看到了关于Paxlovid对Omicron和其他变种有效的有希望的证据。”
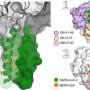
辉瑞公司的治疗方法是一种新的分子PF-07321332和HIV抗病毒药物利托那韦的组合,这两种分子可以单独服用。
EMA表示,它“建议授权Paxlovid用于不需要治疗COVID-19的成年人补充氧气以及疾病恶化风险增加的人群”。
EMA专家研究了一项研究,“该研究表明,使用Paxlovid治疗可显著降低至少有一种潜在疾病可能导致严重COVID-19风险的患者的住院或死亡”。
患者在出现症状的5天内服用了这种药物,在接下来的一个月里,1039名研究对象中只有0.8%的人最终住院,而服用安慰剂的患者中有6.3%入院。
EMA称,Paxlovid组无一例死亡,安慰剂组有9例死亡。
去年12月,EMA批准了单个国家决定是否早期紧急使用Paxlovid,但推迟了在27国集团全面授权的决定。
该监管机构仍在权衡美国制药商默克公司抗冠状病毒药物的类似申请。
不像疫苗,辉瑞公司治疗不针对冠状病毒用来入侵细胞的不断进化的刺突蛋白。
因此,从理论上讲,它应该更不容易变异,该公司表示,初步的实验室研究已经支持了这一假设。
©2022法新社