FDA停止使用抗体药物不起作用与买卖
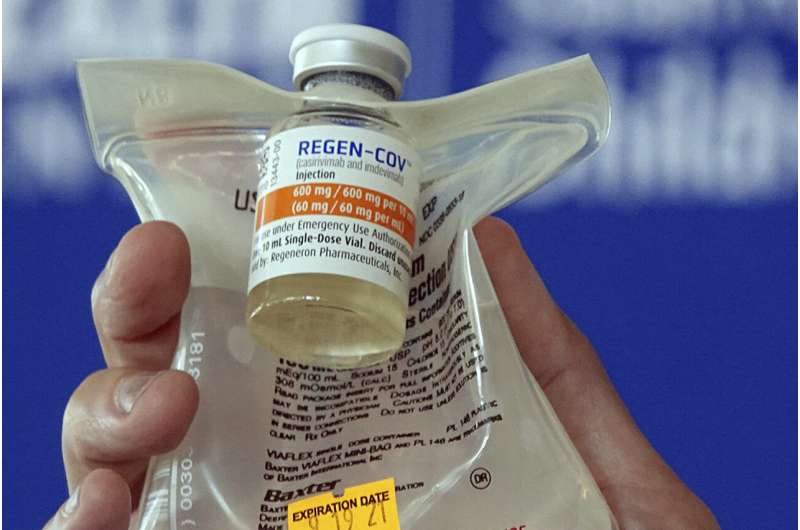
从Regeneron COVID-19抗体药物和礼来公司应该不再被使用,因为他们不工作对ο变体,现在占几乎所有美国感染,美国卫生监管机构周一说。
美国食品和药物管理局说,这是撤销紧急授权这两种药物,购买的联邦政府并管理与COVID-19数以百万计的美国人。如果药物是有效的对未来的变体,FDA说它可以授权其使用。
监管举措预期是因为制药公司都表示,注入药物不能够目标ο由于其突变。不过,联邦行动可能引发阻力从那些共和党州长继续促进药物对健康专家的建议。
ο阻力的两大单克隆抗体药物颠覆了在最近几周COVID-19的治疗策略。
医生替代疗法早期COVID-19战斗情况下,包括两个新的抗病毒药物从辉瑞和默克,但都是供不应求。葛兰素史克公司的抗体药物,仍是有效的也在供应短缺。
virus-blocking的药物使版本抗体。他们的目的是阻止严重的疾病和死亡提供集中剂量的一个或两个早期感染的抗体。时任唐纳德·特朗普收到Regeneron抗体结合后他在2020年的冠状病毒阳性。
FDA的决定指出,ο占超过99%的美国感染,使其“极不可能”的抗体会帮助人们现在寻求治疗。该机构称,限制其使用也会消除不必要的药物副作用,包括过敏反应。
美国政府暂时停止发放两种药物12月下旬,买卖是周游全国,成为占主导地位的变体。但官员们重新分布从共和党州长投诉后,包括佛罗里达州的罗恩DeSantis,他声称这些药物继续帮助一些ο患者。
DeSantis大力推广抗体药物作为他的签名部分政府COVID-19响应,建立输液网站和赞扬他们在新闻发布会,而反对疫苗要求和其他公共卫生措施。德州州长阿博特也推出了政府注入的网站。
药物是不能代替疫苗接种和通常是留给最脆弱的人,包括老人,移植受者和那些有心脏病和糖尿病等病症。
自1月初以来,美国政府已经运送足够剂量的两种抗体治疗300000多名患者。
Regeneron和莉莉此前宣布他们开发新的目标ο抗体。
此举几天后监管机构扩大使用remdesivir-the第一药物批准COVID-19-to治疗更多的病人。
周五,美国食品和药物管理局扩大抗病毒的批准,包括成人和儿童早期COVID-19谁在医院面临的风险也高。Remdesivir以前仅限于住院病人。
一个有影响力的专家小组的联邦已经推荐用注入药物来阻止住院治疗。相同的指导方针从美国国立卫生研究院的面板不建议继续使用莉莉和Regeneron抗体药物由于其减少对ο有效性。
尽管如此,许多医院将面临的挑战加大remdesivir治疗。的药物需要三个连续静脉输液三天,当用于nonhospitalized病人。费时的过程不会更多的产能过剩是一个选择的医院面临人员短缺。
FDA的决定基于560名病人的研究表明减少近90%住院时remdesivir给出七天内症状。研究早于ο变体但是,像其他抗病毒药物,remdesivir预计将保持其性能对最新的变体。
©2022美联社。保留所有权利。材料可能不会被出版,广播,重写或重新分配。