FDA批准Rinvoq治疗特应性皮炎
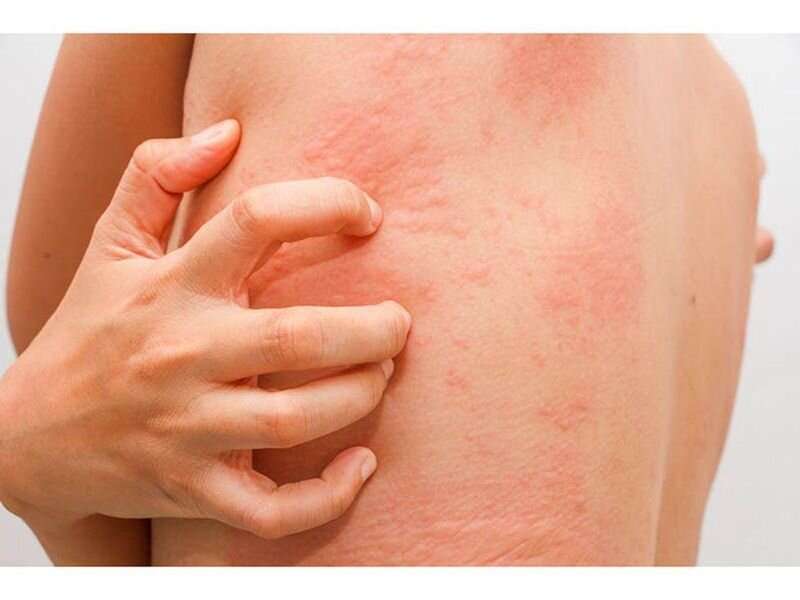
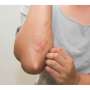
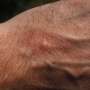
制造商Rinvoq (upadacitinib)周五宣布,美国食品和药物管理局批准Rinvoq (upadacitinib)用于治疗12岁及以上中度至重度特应性皮炎。
表示批准病人患有特应性皮炎,之前的治疗无效治疗并且没有很好地控制其他药物或不建议使用其他药物。12岁及以上体重至少40公斤(88磅)的患者可开始使用15毫克Rinvoq;对于年龄小于65岁的患者,在此剂量下没有达到足够的反应,剂量可增加至30mg,每日一次。
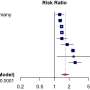
批准是基于三项研究中2500多名患者的疗效和安全性数据。这些患者中约52%曾接受过全身性特应性皮炎治疗。在16周的三项研究中,患者接受每日一次Rinvoq (15 mg和30 mg)单药治疗和联合外用糖皮质激素主要终点为湿疹面积和严重程度指数至少降低75%,经验证的特应性皮炎研究人员全球评估为明显或几乎明显(0/1),与基线相比至少降低了两个等级。与安慰剂相比,早在Rinvoq治疗的第一周,就可以看到严重瘙痒症数值评分≥4的显著改善。
Rinvoq在特应性皮炎患者中的安全性与类风湿关节炎患者的安全性相似。其他不良反应特别针对患有特应性皮炎包括疱疹性湿疹/卡波西水痘爆发。Rinvoq的严重副作用包括感染结核病、50岁及以上有至少一种心血管危险因素的人的死亡风险更高、某些癌症的风险增加以及血栓。
艾伯维获得批准。
更多信息:更多信息请查阅在这里.
2022每日健康。版权所有。