一种危险肝癌的分子细节
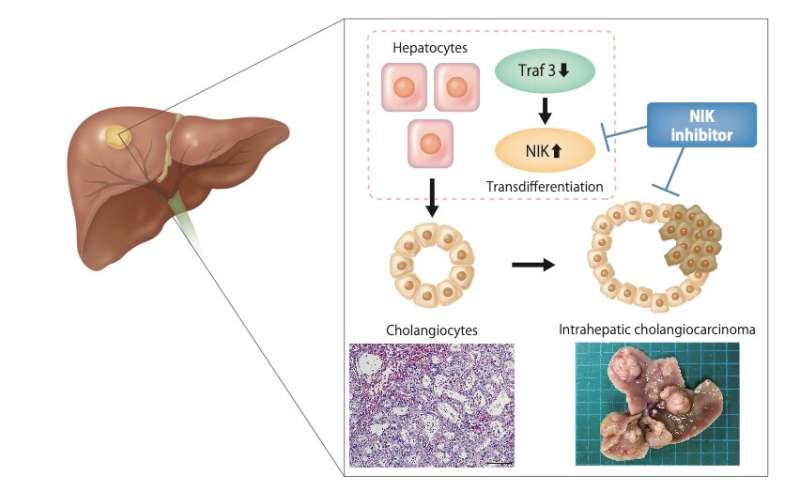
在最近发表于肝脏病学由大阪大学的研究人员领导的一个小组研究了驱动肝内胆管癌(ICC)发展的分子机制,ICC是一种在肝脏胆管中发展的癌症,预后差,死亡率高,并确定了特定的基因,可以作为新型ICC治疗的治疗靶点。
ICC通常在晚期才被诊断出来,因为没有针对这种癌症的筛查计划,也没有任何与之相关的明显危险因素。由于ICC的发病率比30年前高出近10倍,因此迫切需要发现这种癌症的特定异常,从而可能被用作治疗药物的靶点。在癌症生物学中,这些靶点通常是基因/使肿瘤生长失控的蛋白质。因此,大阪大学的研究小组旨在鉴定与ICC肿瘤的发生和进展相关的候选癌症基因(CCGs)。
“在之前的一项研究中,我们的研究小组在各种癌症类型中使用了一种称为插入突变的技术,将突变转座子随机引入实验室小鼠基因组的不同位置,”该研究的主要作者Yuto Shiode说。“这帮助我们确定破坏某种基因或DNA的其他部分是否会导致癌症的发展。”
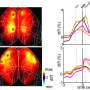
使用这种技术,研究人员专注于在这些缺失PTEN的小鼠中出现的ICC, PTEN是一种已知的ICC的肿瘤抑制因子。对近40万个被破坏的独特基因组位置进行测序表明,一种名为TRAF3的基因在ICC的发展中至关重要。然后,研究人员培养了一种同时敲除TRAF3和PTEN的实验室小鼠肝细胞.
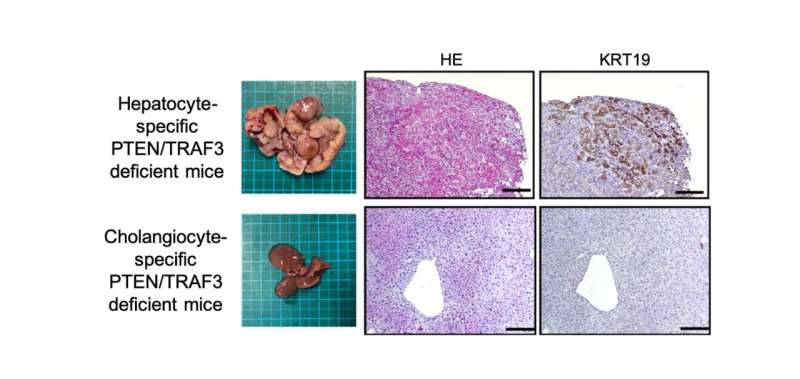
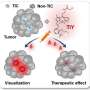
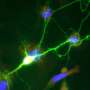
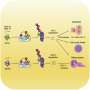
资深作者Takahiro Kodama解释说:“双敲除小鼠显示出一种叫做胆管细胞的细胞类型过度生长,这是胆管中的细胞,并发展成ICC。”“出乎意料的是,直接在胆管细胞中删除这两个基因不会导致肿瘤形成,但在另一种类型的肝细胞中删除它们却会导致肿瘤形成。”
进一步的调查表明癌症来源于肝细胞,其中TRAF3和PTEN的缺失增加了一种名为NF-kB诱导激酶(NIK)的蛋白表达,导致它们转分化为胆管细胞。重要的是,实验抑制NIK活性减少了胆管细胞过度生长。
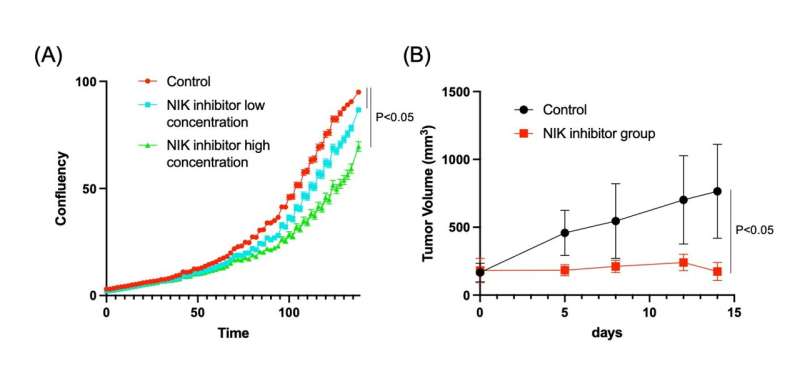
“我们通过几种不同的方法抑制NIK,所有这些方法都抑制了培养中的人类ICC细胞和小鼠模型中的ICC肿瘤的生长,”Shiode描述道。
这些有趣的发现有助于确定肝细胞中TRAF3的失活导致NIK的上调,导致肝细胞向增生性胆管细胞的转分化和ICC的发展。这些数据也提供了强有力的证据,证明阻断NIK活性可能具有临床意义,并且是ICC患者长期以来所需要的治疗干预方法。
更多信息:Yuto Shiode等,Traf3失活通过NIK‐介导的肝细胞转分化促进肝内胆管癌的发展,肝脏病学(2022)。DOI: 10.1002 / hep.32317