科学家公布了世界上第一个Omicron刺突蛋白的分子水平分析
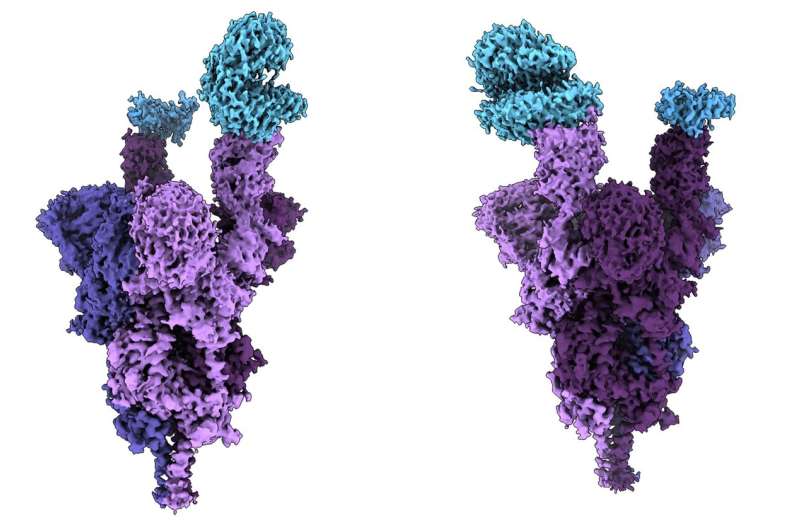
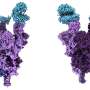
UBC医学院的研究人员对Omicron突变穗蛋白进行了世界上第一次分子水平的结构分析。研究结果发表在今天的科学.
利用低温电子显微镜在接近原子分辨率下进行的分析揭示了严重突变的Omicron变种是如何附着并感染人类的细胞.
“了解病毒刺突蛋白的分子结构很重要,因为它将使我们在未来开发出更有效的治疗Omicron和相关变体的方法,”UBC生物化学和分子生物学系的主要作者Sriram Subramaniam博士(he/him)说。“通过分析病毒感染人类细胞的机制,我们可以开发出更好的治疗方法,破坏这一过程,并中和病毒。”
位于冠状病毒外部的刺突蛋白使SARS-CoV-2能够进入人类细胞。Omicron变种在其刺突蛋白上有前所未有的37个突变,比以前的变种多出3到5倍。
的结构分析揭示了几种突变(R493, S496和R498)在刺突蛋白和人类细胞受体ACE2之间建立了新的盐桥和氢键。研究人员得出的结论是,这些新键似乎增加了结合亲和力——病毒与人类细胞结合的强度——而其他突变(K417N)则降低了这种结合的强度。
“总的来说,研究结果表明,Omicron比原始病毒具有更强的结合亲和力,其水平与我们在Delta变体中看到的更相似,”Subramaniam博士说。“值得注意的是,Omicron变种进化到保留了它与人类细胞尽管有如此广泛的突变。”
研究人员进行了进一步的实验,表明Omicron刺突蛋白显示出增加的抗体逃避。与之前的变种相比,Omicron在这六方面都有明显的规避单克隆抗体测试,完全逃脱五。该变异还显示出从接种疫苗的个人和未接种COVID-19患者收集的抗体增加。
值得注意的是,与未接种疫苗的患者对自然感染的免疫力相比,奥米克隆对疫苗产生的免疫力更低。这表明疫苗接种仍然是我们最好的防御,”Subramaniam博士说。基于观察到的结合亲和力和抗体逃避的增加,研究人员说斯派克蛋白质突变可能是增加Omicron变异传播性的贡献因素。
下一步,萨勃拉曼尼亚姆博士说,他的研究团队将利用这些知识来支持开发更有效的治疗方法。
“我们团队的一个重要关注点是更好地理解中和抗体的结合和对所有变种都有效的治疗方法,以及如何利用这些方法进行开发变体防治疗方法。”