在与常见脑瘤相关的基因突变中发现了“决策开关”
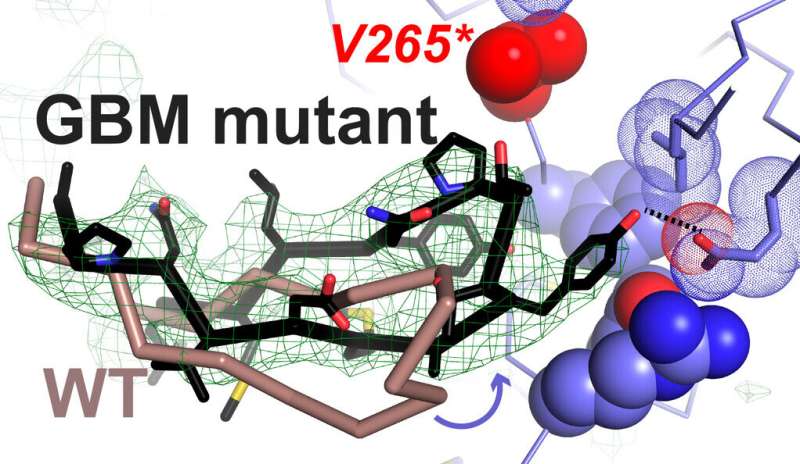
耶鲁大学癌症生物学研究所的研究人员已经明确了多形性胶质母细胞瘤(GBM)中复发的癌症相关肿瘤突变的作用,GBM是最常见和最具侵袭性的恶性脑瘤类型。研究结果发表在今天的自然.
的表皮生长因子受体EGFR在癌症中经常发生突变,是一种重要且成功的治疗靶点,特别是在癌症中肺癌.然而,尽管大约24%的GBM病例发生了EGFR突变,但EGFR抑制剂对这种癌症的治疗并不成功。
在这项新的研究中,研究团队表明,发生在GBM中最常见的细胞外突变会阻止EGFR区分通常激活它的七种不同生长因子。当生长因子的结合使两个受体结合成二聚体时,EGFR被激活。不同的生长因子通常稳定具有不同结构和激活动力学的EGFR二聚体,它们发出不同的信号来指定或偏向细胞结果。有些会阻止细胞生长,而其他的(包括一种被称为表皮生长因子的蛋白质)则会促进细胞生长。耶鲁大学癌症生物学研究所的研究小组发现,在GBM中看到的突变egfr对所有7种受体的不同配体产生反应,就像它们是EGF一样,而EGF会诱导发出信号促进细胞增殖的二聚体类型。
耶鲁大学癌症生物学研究所联席主任、耶鲁大学癌症中心副主任、药理学大卫·a·萨克勒教授、该研究的资深作者马克·莱蒙说:“最初人们认为这些突变只是激活了EGF受体,很像在肺癌中看到的突变,但我们的研究结果表明,它们也改变了受体给出的信号类型。”“我们的研究结果为EGF受体如何区分一种激活生长因子提供了新的见解,而随着这些突变的发生,这种区分能力就丧失了。”
在研究所莱蒙实验室和弗格森实验室的合作努力中,耶鲁大学的研究科学家Anatoly Kiyatkin发现,GBM突变降低了EGFR区分EGF和外调节素(EREG)的能力,EREG是细胞检测中与EGF受体结合的另一种生长因子。该研究的第一作者、研究生胡春(音)表示,突变允许EGFR形成强二聚体,以响应EREG和其他低亲和配体。利用x射线晶体学,Hu与耶鲁大学本科生Carlos a . Leche合作,展示了两种GBM突变如何改变受体激活过程,从而使EREG驱动通常与EGF相同类型的信号二聚体。
基于这些发现,研究人员认为EGFR改变的配体识别在发育中的重要作用多形性成胶质细胞瘤这对这种癌症和其他癌症的靶向治疗具有潜在意义。莱蒙说:“我们的结果展示了细胞工作、溶液生物物理学和晶体学的良好结合——展示了氨基酸侧链的一个微小变化如何改变生物学的方向。”
GBM占所有原发性恶性脑的48%肿瘤预计今年将有超过13000名美国人被诊断出患有GBM。GBM患者的5年生存率仅为6.8%,平均生存期估计仅为12 ~ 18个月。
进一步探索