研究人员恢复了一种基因的功能,该基因可以抑制肝癌并增强免疫治疗
来自马萨诸塞州总医院(MGH)和布里格姆妇女医院(BWH)的一组研究人员通过使用mRNA纳米颗粒重新编程了肝癌的肿瘤微环境。该技术与新冠肺炎疫苗使用的技术相似,恢复了疫苗的功能p53主控调节基因,一种肿瘤抑制基因,不仅在肝癌中发生突变,而且在其他类型的癌症中也发生突变。当与免疫检查点阻断(ICB)联合使用时,p53 mRNA纳米颗粒方法不仅抑制了肿瘤生长,而且显著增加了肝细胞肝癌(HCC)实验室模型的抗肿瘤免疫应答。研究结果发表在自然通讯.
“肿瘤微环境的细胞和分子组分的重新编程可能是治疗HCC和其他癌症的一种革命性的方法,”BWH纳米医学中心的共同高级作者Jinjun Shi博士说,他与MGH肝癌生物学家和共同高级作者Dan G. Duda, DMD,博士一起开发了平台。“通过使用这种新方法,我们瞄准了特定的通路肿瘤细胞信使rna纳米颗粒。这些微小的颗粒为细胞提供了构建蛋白质的指令,在HCC的情况下,这延缓了肿瘤的生长,并使肿瘤对免疫疗法的治疗更有反应。”
肝癌是最常见的肝癌形式,其特点是死亡率高,患者预后不佳。免疫检查点阻滞剂是一种革命性的新型药物,它能使人体免疫系统识别并攻击癌细胞,在治疗HCC方面显示出疗效,但大多数患者并未受益。为了克服这种耐药性,人们正在开发多种策略,通过将ICBs与其他现有疗法(如抗vegf药物和放疗)结合起来改善ICBs。然而,即使是这些方法也只能使少数患者受益,因此迫切需要新的联合疗法。
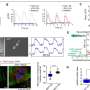
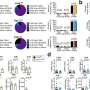
受信使rna在COVID-19疫苗中成功的鼓舞,史教授决定将该技术(经过一定修改)应用于靶向癌细胞。他与杜达合作,杜达的MGH实验室已经创建了复杂的动物模型,以分析肝脏肿瘤对免疫治疗的反应的微环境。他们开发和优化了一种信使rna纳米颗粒策略,以恢复失去的功能p53在超过三分之一的HCC病例中,这种抑癌基因失去了功能。在此过程中,他们发现了p53作为ICB治疗的一部分,通过调节癌细胞与免疫细胞的相互作用来调节肿瘤微环境的证据。
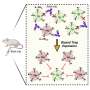
“在我们之前的工作中,我们开发了靶向cxcr4(肝脏表达的趋化因子受体)的纳米颗粒癌症细胞和选择性地共同传递激酶抑制剂等药物,”杜达解释说。“我们现在已经改造了这个平台,使用CXCR4作为一种邮政编码,用纳米颗粒封装治疗性信使rna选择性靶向肿瘤。当我们将这种纳米药物与抗程序性死亡受体1 (PD-1)抗体(HCC患者的一种标准免疫疗法)联合使用时,它诱导了肿瘤微环境的全局重编程肿瘤响应通过恢复p53表达。”
该团队的下一步是将他们的研究从动物模型转移到临床试验中的患者身上。几十年来,科学家们一直在努力寻找一种有效的方法肿瘤抑制基因通路”,强调史。“我们的概念验证研究是一个令人兴奋的进展,清楚地表明p53 mRNA纳米颗粒与ICB结合不仅有效,而且还可以通过逆转HCC和潜在的其他癌症的免疫抑制产生很大的影响。”
Shi是哈佛医学院(HMS)的麻醉学副教授。Duda是HMS放射肿瘤学副教授,也是MGH GI放射肿瘤学转化研究主任。肖玉玲博士和陈江博士是该研究的主要作者和HMS的博士后。
进一步探索