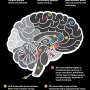
研究发现线粒体功能障碍和年龄依赖性认知障碍之间可能存在联系
线粒体电子传递链是细胞过程中产生能量所必需的,也会产生攻击组织并引起氧化损伤的活性氧(ROS)。这种损伤可引起线粒体功能障碍,甚至导致细胞死亡。由于我们的大脑比其他器官消耗更多的氧气,它更容易受到这种活性氧损伤。
根据文献,ROS还会导致淀粉样蛋白β (a β)的积聚,这标志着阿尔茨海默病(AD)的发病,这是一种严重的不可逆神经退行性疾病。治疗阿尔茨海默症并不能阻止它的发展,需要新的治疗方法的发展。
在之前的一项研究中,一组科学家发现,缺乏维生素E的老年大鼠体内的氧化水平远远高于年轻大鼠。此外,通过线粒体氧化产生的ROS可能损伤脑细胞,这意味着AD和线粒体功能障碍之间存在密切联系。为了加深这一认识,同一组科学家现在已经证明,AD的进展与氧化性脑损伤密切相关。这项研究由福井浩司教授、他的同事吉田直树先生、加藤裕吾先生及高松裕胜教授领导,并于最近发表于共同参与.“我们发现氧化对线粒体产生了负面影响,从而导致认知功能障碍,”该研究的通讯作者Fukui教授解释说。
科学家们使用了三组AD老鼠3个月,6个月,20个月,以及健康对照组。为了测试它们的认知和协调能力,研究人员进行了两个著名的实验:莫里斯水迷宫和旋转杆测试。他们发现,AD小鼠需要更长的时间来完成迷宫目标,但并没有放慢速度。在旋转杆测试中,6个月和20个月大的AD小鼠在杆上停留的时间更长,而年龄匹配的对照组小鼠下降得更快。Fukui教授解释说:“下降时间的差异可以归因于两组小鼠之间的体重差异,因为对照组小鼠比AD小鼠重。”这些结果表明,AD小鼠认知受损,但没有任何协调问题。
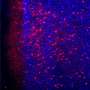
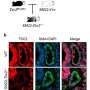
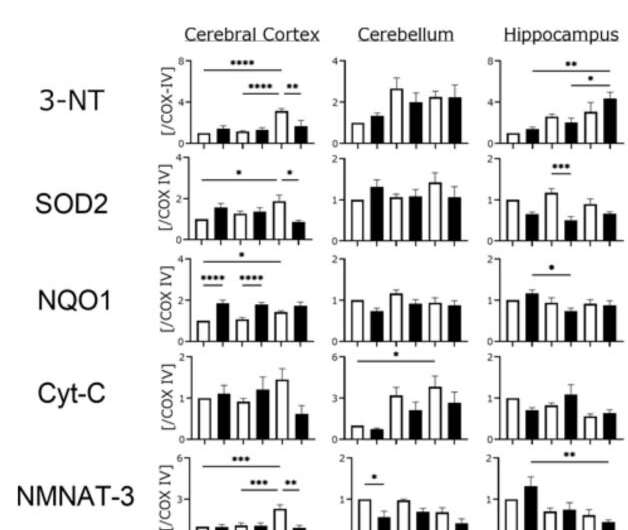
为了确定哪些ad相关蛋白质导致了这种认知障碍,作者从两组小鼠的大脑不同部位收集了组织样本,并评估了样本中的氧化标记物水平。首先,他们发现AD小鼠的a β水平较高,并随着年龄的增长而逐渐增加。令他们惊讶的是,海马体中与ad相关的蛋白质Aβ1-42明显高于大脑的其他部分。然而,他们没有发现tau蛋白水平的任何变化,tau蛋白是AD病理中积累的另一个标记物。总之,我们证实了Aβ1-42在海马体中的聚集导致了AD小鼠的认知障碍。
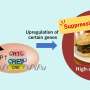
研究小组还推测ros诱导的线粒体损伤与神经元存活密切相关。为了验证他们的假设,他们测定了一些关键的线粒体氧化酶的水平,包括具有抗衰老作用的烟酰胺-核苷酸腺苷转移酶(NMNAT)-3。虽然NMNAT-3被发现降低,但在AD小鼠中,3-NT(3-硝基酪氨酸)水平,一种更高氧化的指标,随着年龄的增长而增加。“随着NMNAT-3水平的降低和3-NT水平的升高,氧化是很明显的原因线粒体功能障碍,并最终导致认知功能障碍Fukui教授评论道。
研究小组对他们的研究结果的潜在影响持乐观态度,特别是在增加抗氧化化合物的摄入量方面,这些化合物可以帮助我们的身体减轻ROS。事实上,许多天然抗氧化剂,如维生素E和C,可以从饮食中获得。Fukui教授总结道:“如果线粒体能够免受ROS的伤害,那么线粒体功能和认知功能可能会得到维持。未来的研究应集中于开发诊断标志物,以检测大脑的早期变化,以及探索线粒体中具有高抗氧化活性的化合物。”