Piezo1可能是支持杜氏肌营养不良肌再生的关键
宾夕法尼亚大学佩雷尔曼医学院的一个研究小组称,一种名为Piezo1的蛋白质是组织肌肉干细胞独特形状和对损伤做出反应的关键,但在杜氏肌营养不良症患者中,这种蛋白质的供应量很低。然而,当他们重新激活Piezo1时,它使小鼠的肌肉干细胞恢复到正常的、形状独特的状态,这样它们就可以修复受损的营养不良肌肉。这些发现发表在科学的进步这为潜在的分子水平治疗打开了大门,这些治疗可能会减缓甚至停止肌肉萎缩症的进展。
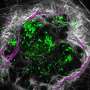
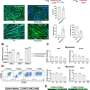
“我们证明了肌肉干细胞有各种各样的延伸,用来感知他们的环境,以对受伤做出反应,所有这些都是由Piezo1蛋白控制的,”该研究的主要作者,骨科外科助理教授Foteini Mourkioti博士说。“这与之前的观点相反,人们认为肌肉干细胞只是圆形的,在未受损的肌肉中处于休眠状态。”
Piezo1蛋白是在大约十年前被发现的他去年获得了诺贝尔奖对于那些发现它的人来说,它在骨骼肌中的功能在很大程度上是未知的。然而,当宾夕法尼亚大学的研究人员在肌肉干细胞中检测它时,他们发现它控制着细胞的形成方式,并协调它们对肌肉损伤的反应。
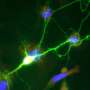
通常情况下,肌肉干细胞被身体调用来修复肌肉组织损伤。对于它们是如何做到这一点的,我们知之甚少,因为大多数关于它们的研究都是通过在实验室中进行的时间点观察来完成的。但是Mourkioti和她的团队能够观察小鼠,并发现它们的肌肉干细胞有用于相互交流的突出物,这使它们看起来类似于神经元(神经细胞).
Mourkioti的团队还发现肌肉干细胞以三种不同类型的平衡存在:反应性(或活性)细胞,中间细胞和感觉细胞(更接近未分配的干细胞)。细胞越活跃,突起就越少,而感觉干细胞通常有更多的突起。在受伤过程中,研究人员观察到肌肉干细胞的反应细胞专注于快速反应。如果损伤足够大或需要足够长的时间,中间细胞和最终的感觉细胞就会被引入来处理损伤并相应地调整它们的形态。
实际上,如果肌肉干细胞像军队一样组织起来,那么具有较少(或没有)突起的反应细胞将成为突击部队,而具有四个或更多突起的感觉细胞相当于将军在前线部队不堪负荷时可能调用的预备队。当这些储备细胞被召集起来时,它们会改变形态,减少突起。
在军队场景中,Piezo1蛋白将扮演将军的角色。这些蛋白质似乎有能力决定每个细胞上突起的形式。
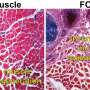
杜氏肌营养不良症是一种遗传性疾病,其特征是肌肉的持续破坏,因此需要不断的修复。研究发现,患有营养不良肌肉的小鼠干细胞中Piezo1的水平明显低于没有这种疾病的小鼠。当研究人员观察营养不良小鼠的肌肉干细胞对损伤的反应时,他们注意到从感觉状态转移到活动状态的显著延迟。细胞也有更厚更长的突起,这表明它们没有得到适当的控制。
实际上,如果没有一个能干的将军领导,肌肉干细胞大军就会陷入混乱,修复杜氏肌营养不良造成的损伤所需的大量反应会让它不堪重负。
然而,通过这些观察,Mourkioti和她的团队相信他们发现了扭转局势的关键。
通过一种被称为Yoda1的小分子治疗,Piezo1的通道在肌肉营养不良的动物体内重新开放。通过这种方法,他们注意到肌肉干细胞恢复了正常的结构和功能,肌肉再生似乎比以前更强。
“尽管过去十年在治疗杜氏肌营养不良症方面取得了进展,但目前的策略仍然没有采取肌干细胞正在考虑,”Mourkioti说。“但如果我们专注于最小化干细胞衰竭和保持肌肉再生能力干细胞我们的工作表明,重新激活Piezo1可能是解决这一问题的关键,可以单独使用,也可以与其他疗法联合使用。”
这项工作不仅对杜兴有特殊的意义肌肉萎缩症但它也可能有益于那些由于干细胞能力受损(包括自然衰老)而导致肌肉无力的人。
Mourkioti和她的团队希望研究是否需要额外的注射治疗来维持肌肉干细胞的活性。他们还希望进一步研究Piezo1在体内的功能,并在体重与人类相当的临床前营养不良动物模型上做更多的测试。
Mourkioti说:“更好地理解Piezo1的工作方式可能有助于设计更精确的治疗方法。”
进一步探索