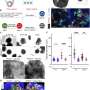
SARS-CoV-2刺突蛋白比早期版本更稳定,变化更慢
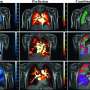
对SARS- cov -1和SARS- cov -2刺突蛋白与人类细胞受体融合前行为的新计算模拟表明,导致COVID-19的SARS- cov -2病毒比导致2003年SARS流行的早期版本更稳定、变化更慢。
严重急性呼吸综合征冠状病毒1和2 (SARS-CoV-1和SARS-CoV-2)有惊人的相似之处,研究人员还没有完全理解为什么后者更具传染性。
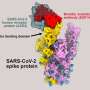
它们的穗蛋白与宿主细胞血管紧张素转换酶2结合,也被称为人类细胞受体,已被锁定为不同传递性的潜在来源。在结合之前了解刺突蛋白的机制细节可以帮助开发更好的疫苗和药物。
这项新发现并不一定意味着SARS-CoV-2更有可能与细胞受体结合,但它确实意味着它的刺突蛋白有更好的机会有效结合。
“一旦它找到细胞受体富布赖特艺术与科学学院的化学和生物化学副教授马哈茂德·莫拉迪说:“当SARS-CoV-2与它结合时,它更有可能保持结合,直到完成完全附着在细胞上并开始进入细胞的其他必要步骤。”
为了确定两种病毒之间构象行为的差异,Moradi的研究团队对SARS-CoV-1和SARS-CoV-2刺突蛋白的分子动力学进行了大量的平衡和非平衡模拟,最终与细胞结合血管紧张素转化酶2。3D模拟是在微秒级别上完成的,使用了COVID-19高性能计算联盟提供的计算资源。
平衡模拟允许模型在自己的时间内自发地进化,而非平衡模拟使用外部操作来诱导系统中所需的变化。前者的偏差较小,但后者的速度更快,并允许运行更多的模拟。两种方法都提供了一致的图像,独立论证了相同的结论,即SARS-CoV-2刺突蛋白更稳定。
模型还揭示了其他重要的发现,即能量势垒与SARS-CoV-2激活相关的蛋白含量更高,这意味着结合过程发生得很慢。缓慢的激活可以使刺突蛋白更有效地避开人体免疫反应,因为长时间保持不活跃状态意味着病毒不能被靶向受体结合域的抗体攻击。
研究人员了解所谓的受体结合域(RBD)的重要性,这是病毒的关键部分,使其能够与人类细胞受体对接,从而进入细胞并引起感染。Moradi团队制作的模型证实了受体结合结构域的重要性,但也表明其他结构域,如n端结构域,可能在SARS-CoV-1和-2刺突蛋白的不同结合行为中发挥关键作用。
蛋白质的n端结构域位于多肽链的n端或简单地说位于多肽链的起点,与位于多肽链末端的c端相反。虽然n端结构域位于受体结合域附近,并且被一些抗体靶向,但目前还不完全了解SARS-CoV-1和-2刺突蛋白中的n端结构域的功能。Moradi的团队首次发现了n端结构域和受体结合结构域之间潜在相互作用的证据。
Moradi说:“我们的研究揭示了SARS-CoV-1和SARS-CoV-2刺突蛋白的构象动力学。”“它们动态行为的差异峰值蛋白质几乎可以肯定,这导致了传播性和传染性的差异。”
进一步探索