Axicabtagene ciloleucel被批准用于大b细胞淋巴瘤的二线治疗
Axicabtagene ciloleucel(轴胞;美国食品和药物管理局(fda) 4月1日宣布,Yescarta被批准用于治疗一线化疗免疫治疗难治或一线化疗一年内复发的大b细胞淋巴瘤(LBCL)。
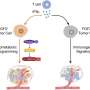
这种嵌合抗原受体(CAR) t细胞疗法的批准为LBCL的标准护理提供了一种替代方案,这是一个多步骤的过程,从化学免疫治疗开始,然后涉及高剂量化疗和a干细胞移植适用于对进一步治疗有反应并能耐受的患者。CAR - T细胞疗法是由患者的白细胞(T细胞)制成的,这些细胞被提取出来,送到专门的制造工厂进行改造,以治疗患者的癌症,然后再注入患者体内。医生和患者可以通过美国授权的治疗中心开始接受Yescarta t细胞疗法。
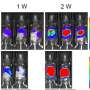
FDA的批准基于来自ZUMA-7的数据,ZUMA-7是一项随机、开放标签、多中心试验,共有359名原发性难治性LBCL患者或在一线治疗完成后一年内复发。研究人员随机分配患者在氟达拉滨和环磷酰胺淋巴衰竭化疗后单次输注axis -cel,或对完全或部分缓解的患者进行二线化疗,包括2或3个周期的化疗免疫治疗,然后是大剂量治疗和自体造血干细胞移植。
轴状细胞组的患者获得了明显更长时间的无事件生存率(风险比,0.40),与标准治疗组的17.0%相比,估计18个月无事件生存率为41.5%。轴心组和标准治疗组的估计中位无事件生存期分别为8.3个月和2.0个月。
axis -cel的处方信息包括一个盒装警告细胞因子释放综合征还有神经毒性。最常被报道的不良反应包括细胞因子释放综合征、发热、低血压、脑病、疲劳、心动过速、头痛、恶心、发热性中性粒细胞减少、腹泻、肌肉骨骼疼痛、感染、寒战和食欲下降。
Kite Pharma Inc.获批。
更多信息:FDA的批准
©2022每日健康.版权所有。