FDA书营销的新的测试帮助诊断阿尔茨海默氏症
美国食品和药物管理局授予营销批准Lumipulse Gβ-Amyloid比率(1-42/1-40)测试,第一个体外诊断测试的早期发现与阿尔茨海默病相关的淀粉样斑块,该机构周三宣布。
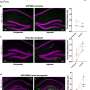
的测试55岁及以上患者表示现在和谁认知障碍和被评估为阿尔茨海默病和认知能力下降。测试提供了另一个潜在的昂贵的正电子发射断层扫描(PET)扫描来检测病人的大脑淀粉样斑块,通常几年前临床症状出现。Lumipulse测试是用来测量的比率β-amyloid 1-42第1 - 40和β-amyloid脑脊髓液中的浓度(CSF)来帮助医生确定病人可能是阿尔茨海默病的一个标志是淀粉样斑块。FDA指出,必须解释结果与其他病人的临床资料。
”Lumipulse测试中,有一个新的选项,通常可以在同一天完成,可以给医生相同的信息关于大脑淀粉样状态,没有辐射危险,来帮助确定病人的认知障碍是由于阿尔茨海默氏症,”杰夫均,医学博士,法学博士FDA中心主任设备和放射卫生,FDA在一个新闻发布会上说。
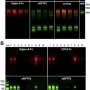
市场营销授权是基于安全性和有效性的数据292份脑脊液样本的临床研究阿尔茨海默病的神经影像学样本银行。百分之九十七的患者Lumipulse Gβ-Amyloid比率(1-42/1-40)阳性结果的存在淀粉样斑块PET扫描,84%的负面结果-淀粉PET扫描。
有风险的假阳性和假阴性结果Lumipulse Gβ-Amyloid比率(1-42/1-40)测试。“重要的是,Lumipulse Gβ-Amyloid比率(1-42/1-40)并不是一个独立的测试和其他临床评估或额外的测试应该被用于确定治疗方案,”FDA在新闻发布会上。
FDA允许测试Fujirebio诊断公司的营销。
进一步探索
版权©2022每日健康。保留所有权利。