增强对癌症的免疫反应
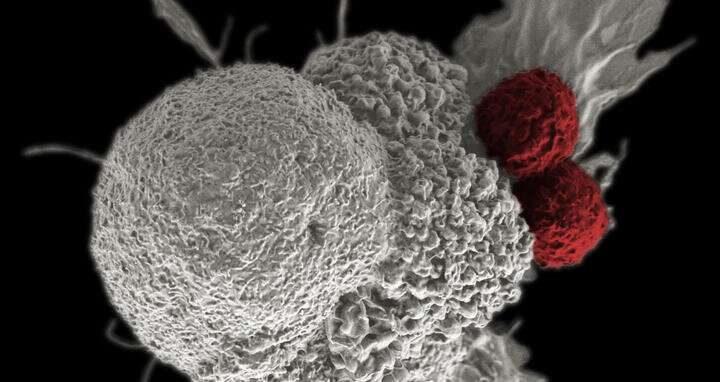
T细胞通常擅长消灭病变细胞,但它们似乎在消灭肿瘤细胞时失败了。在江森自控的洞察力由Armin Rehm和Uta Höpken领导的MDC团队描述了抑制这种免疫功能的因素,以及他们如何释放刹车并增强对癌症的免疫反应。
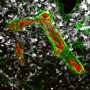
T细胞是免疫系统的特警队。它们的工作是不断地巡视血液、淋巴系统、组织和器官。如果它们遇到被病原体污染或损坏的细胞,它们就会消灭它们。它们还能识别并摧毁癌细胞。但问题是肿瘤细胞想办法逃离这道防线。世界各地的研究人员都在努力防止这些规避操作,并利用T细胞进行靶向免疫治疗癌症。
由柏林亥姆霍兹协会(MDC) Max Delbrück分子医学中心的Armin Rehm博士和Uta博士Höpken领导的实验室现在已经确定了肿瘤细胞用来躲避人体免疫反应的机制。
“在许多情况下,肿瘤细胞尤其频繁地读取EBAG9基因。然后这些细胞会产生一种保护它们的蛋白质。但是EBAG9也会影响免疫系统的细胞,因为T细胞也会产生它。在T细胞中,EBAG9抑制酶的分泌,这些酶可以作为毒药杀死肿瘤细胞,”Rehm说。
写日记江森自控的洞察力在Rehm的研究小组工作的共同主要作者Anthea Wirges博士说:“我们关闭了EBAG9基因。”“这意味着我们可以阻止T细胞产生EBAG9,并长期加强对癌症的免疫反应。”
EBAG9解除了免疫细胞的武装
科学家们已经知道癌细胞可以智胜免疫细胞.这一认识导致了检查点抑制剂的发展,这是一种已经在临床使用的免疫疗法。检查点抑制剂使癌细胞难以欺骗T细胞,使其认为它们是无害的。Rehm说:“但是EBAG9给癌细胞提供了对抗我们免疫系统的另一道防线。”“它能解除免疫细胞的武装,阻止它们分泌对人体有害的物质癌症细胞."
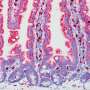
Rehm和Höpken一直怀疑EBAG9能抑制T细胞。2009年,Rehm的令团开发了一种小鼠模型研究人员关闭了EBAG9基因。Rehm说:“在没有EBAG9的情况下,小鼠的免疫系统工作得更好,它们能够更有效地对抗感染。”Höpken的团队随后将不含ebag9的小鼠与另一种自发发生白血病的转基因小鼠模型进行杂交。Höpken说:“我们在很长一段时间内观察了这些双重改造的小鼠。”“它们的肿瘤比携带EBAG9的小鼠发育得慢得多。”
癌症和感染会引发不同的免疫反应
Wirges使用单细胞RNA测序和生物信息学方法检查了EBAG9基因对T细胞的影响。除了证实EBAG9抑制T细胞反应外,这些数据还表明,对癌症的免疫反应不同于由感染引发的免疫反应。
“关于免疫系统如何形成‘记忆’的知识来自感染模型。它不能以1:1的比例转移到肿瘤中,”Rehm说。T细胞通过其表面的信号分子识别患病或受感染的细胞。当它们检测到这些有害结构时,就会分化成细胞毒性T细胞和记忆T细胞。
细胞毒性T细胞分泌蛋白质,在目标细胞的膜上打孔,这样它们就能穿透目标细胞,通过中毒杀死它。感染的组织也会产生炎症信号分子例如细胞因子,它们会召唤更多的T细胞,并使它们成熟为记忆T细胞。存储单元记录免疫反应这样每当T细胞检测到疾病时,免疫系统就不必从头开始了。
这个想法是:创造没有免疫刹车的CAR - T细胞
肿瘤在早期不会引起炎症。此前,科学家们认为这是因为T细胞不能很好地识别肿瘤细胞。“因为它们是由身体产生的,肿瘤细胞的表面分子很少可以被识别为外来物,”Höpken说。但似乎这些微小的差异就足以让T细胞发现肿瘤细胞:当研究人员关闭EBAG9时,反应是惊人的。Rehm指出:“未受抑制的T细胞很早就从根本上消除了肿瘤细胞。”这也为对抗肿瘤细胞提供了持久的保护。“最初的T细胞反应越强,随后的T细胞记忆就越好,”Rehm说。
“基于这些发现,我们现在希望开发不含EBAG9的CAR - T细胞作为白血病的免疫疗法,”Wirges说。CAR代表嵌合抗原受体-一种检测肿瘤细胞并与患者自身T细胞结合的人工受体。当患者接受CAR - t细胞输注时,它会让他们的身体拥有能够对抗癌症的细胞。MDC的研究人员预计CAR - T细胞在没有EBAG9的情况下会更有效。尽管这些细胞进入临床试验阶段还需要一段时间,但等待是值得的:“我们不仅仅希望这种疗法能更有效地治疗白血病和淋巴瘤。我们希望它能治愈他们,”雷姆说。
进一步探索