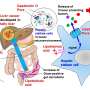
将T细胞推向“记忆巷”可能会改善癌症治疗
圣裘德儿童研究医院的科学家确定了一种分子机制,该机制在一项临床前研究中解锁了对实体瘤治疗的汽车T细胞治疗的希望。结果今天发表在杂志上自然。
“我们的工作从T淋巴细胞的基本生物学扩展到诊所的可能应用,并沿途进行了深层分子机制,”圣裘德免疫学系的共同作者道格·格林(Doug Green)表示。椅子。“我们发现,就像我们许多人一样,如果您是一个活化的T细胞,那么您生命早期就会发生的事情会影响您后来的发展。我们确定蛋白质C-MYC与T-早期的复杂CBAF之间的相互作用细胞活化影响细胞命运轨迹。”
嵌合抗原受体(CAR)T细胞是一种免疫疗法,可修饰患者的免疫细胞靶向癌细胞。这种类型的疗法在治疗白血病和淋巴瘤的儿童和成人方面取得了巨大的成功,尤其是在复发患者中。然而,对实体瘤的CAR T细胞并没有取得相同的成功,涉及持久性和功能的问题。
目前,太多的汽车T细胞成为效应细胞,即直接杀死感染或癌细胞的细胞。从长远来看,很少有人会成为持续存在并创建更多T单元的存储单元。研究人员认为,如果他们创建了更多的记忆细胞,他们可以改善汽车T-细胞疗法。
格林说:“效应细胞可以工作,然后死亡。”“记忆细胞会粘住并可以产生效应细胞(同时维持记忆细胞池),因此它们可以发射持续的攻击。因此,我们认为记忆细胞可能会更好地摆脱肿瘤。”
一个分子神秘
研究人员需要找到指导T细胞成为效应子或记忆类型的方法,然后使用该知识来修改过程。当T细胞被抗原(例如病毒或与癌症相关的分子)激活时,该过程开始。该父母T细胞分为两个子细胞,它们可以成为效应子或记忆单元。
格林的组最近表明,蛋白质C-MYC在亲本T细胞中的分布对于此过程很重要。研究人员知道,具有更多C-MYC的子细胞成为效应细胞。在这项研究中,小组发现蛋白质复合物CBAF(典型的BRG1/BRG相关因子)与C-MYC相互作用。具有高CBAF和C-MYC浓度的子细胞成为效应T细胞。
CBAF结合染色质,蛋白质的某些区域在DNA上。该发现表明,它可以通过控制效应细胞相关基因的表达来指导细胞命运,它们成为哪种类型的T细胞。
CBAF的分布发生在开始的第一个激活的T细胞中自适应免疫反应;因此,研究人员意识到细胞命运是在免疫反应早期决定的。
一个偶然的发现与合作
格林博士的小组正在研究T细胞分区时,圣裘德免疫学系的共同对应作家洪博·奇(Hongbo Chi,Ph.D.)正在研究T细胞如何成为记忆细胞。Chi的实验室使用基因筛选工具CRISPR来敲除基因并观察到对T细胞命运的影响。
Chi说:“ T细胞代表了癌症免疫疗法的基石。”“对于改善T细胞功能以改善癌症治疗的持续兴趣。因此,我的实验室有兴趣识别T细胞记忆反应中的代谢驱动因素。鉴于代谢和表观遗传途径之间的串扰,我们进行了Vivo CRISPRT细胞记忆的表观遗传调节剂的屏幕。这使我们进入了CBAF。”
格林说:“我们正在研究激活T细胞中CBAF复合物的成分发生了什么。”“与此同时,Chi实验室一直在一个充满分子的池塘中钓鱼,这些分子可能会影响细胞命运以产生效应子与记忆T细胞。当我们比较笔记时,我们意识到我们的独立发现告诉我们一些有趣的东西,因此我们联手了。”
这些小组共同努力确认靶向CBAF复合物的多个部分会影响内存T细胞生成。研究人员还发现了CBAF组件结合的基因组中的确切位置,并发现CBAF促进了与效应细胞功能相关的基因的表达。
一起反对肿瘤
合作者使用他们发现的分子信息来提高汽车T细胞功效。他们在CAR T细胞激活期间应用了CBAF抑制剂,以生成更多的记忆T细胞。在临床前模型中,抑制剂处理的T细胞比未处理的细胞更好地控制肿瘤生长。处理过的细胞还存活更长,数量较大。研究人员在多种实体瘤类型中复制了有希望的结果。该研究是最早表明可以瞬时修改CAR T细胞以更有效地杀死实体瘤的研究之一。
Chi说:“ CBAF因素是增强CAR-T治疗作用的潜在目标,但我们的工作也表明,通过更好地理解基本的免疫生物学和T细胞功能,我们可以为癌症和其他疾病开发更好的治疗疗法。”
进一步探索