绘制肺癌的“能量指纹”导致对基本治疗方法的重新思考
墨尔本的研究人员发现,癌症和免疫细胞依赖于来自我们身体的相同能量来源来茁壮成长,这可能会引发对一些肺癌患者治疗方案的根本重新思考。
wehi领导的研究发现了一种目前用于治疗一种侵袭性脑炎的方法肺癌在临床试验中,它无意中阻止了免疫细胞保护身体免受疾病的侵害。
该研究绘制了所涉及的“能量指纹”,表明旨在抑制肿瘤生长同时增强免疫系统的治疗方法可能适得其反。
虽然肺癌在澳大利亚每年仅占癌症诊断的十分之一,但它仍然是癌症相关死亡的主要原因。肺腺癌是澳大利亚诊断出的最常见的亚型,占所有肺癌的40%。
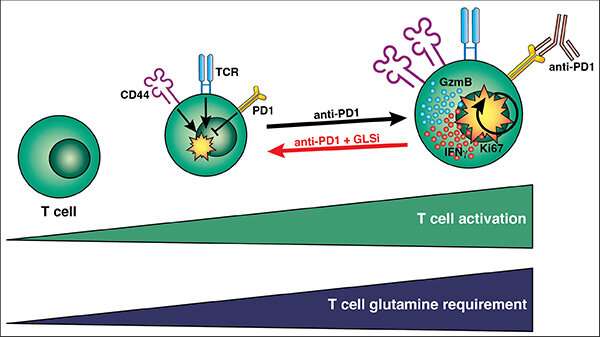
免疫疗法是一种新兴的癌症治疗方法免疫系统增强T细胞(对人体对抗癌症至关重要的免疫细胞)的能力,目前正被用于治疗多种癌症肺腺癌病人。
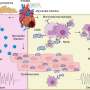
肿瘤通常依靠谷氨酸盐来生长和存活。谷氨酰胺酶抑制剂已经被开发出来,通过阻止谷氨酸释放能量来抑制癌症肿瘤的生长。
目前在临床试验中的联合疗法包括谷氨酰胺酶抑制剂和免疫疗法,研究人员希望通过阻断这种方法提供双重益处肿瘤的生长以及超级T细胞。
但是由WEHI的Sarah Best博士和Kate Sutherland副教授领导的一项新研究,与美国Peter Doherty研究所和Agios制药公司合作,对这种联合治疗是否有益进行了根本性的反思。
这项研究发表在细胞代谢.
意想不到的发现
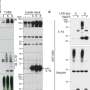
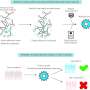
主要作者莎拉·贝斯特博士说,测试谷氨酰胺酶抑制剂临床前模型取得了令人惊讶的结果。
贝斯特博士说:“我们发现,这种药物不仅能阻止肿瘤的活动,还能阻止T细胞的活动,T细胞对人体杀死这些肿瘤至关重要。”
“免疫疗法通过增强T细胞的活性来发挥作用。我们的研究结果表明,谷氨酰胺酶抑制剂抵消了免疫疗法的好处,因为这种药物会抑制T细胞的功能,保护我们的身体。”
研究人员说,这一发现是至关重要的,考虑到病人临床试验目前正在接受这种联合免疫治疗和谷氨酰胺酶抑制治疗。
“这些免疫细胞依赖谷氨酸盐和谷氨酰胺酶的活性来茁壮成长,就像癌细胞一样,我们的研究已经证明了这一点代谢途径对T细胞抗肿瘤活性至关重要,”贝斯特博士说。
能量指纹
超过三分之一的肺腺癌在基因 kras中有一个常见的致癌突变,这是一种强大的癌症驱动因素。
该研究小组此前已经确定,同时发生的其他突变改变了kras突变肺腺癌的性质。
副教授Kate Sutherland说,新发现建立在这项研究的基础上,通过展示独特的能量来源如何促进具有不同共突变的肿瘤的生长,被称为STK11/Lkb1和KEAP1。这一发现是通过研究中使用的复杂的临床前模型而实现的。
Sutherland副教授说:“就像没有两个指纹是相同的一样,我们发现每个共同发生突变的代谢物指纹改变了kras突变肺腺癌的能量使用。”
“这很重要,因为到目前为止,人们的注意力主要集中在关键突变上,比如KRAS。
“我们的工作强调了在没有‘一刀切’方法的情况下研究其他共突变的重要性,因为这些额外的突变在推动肿瘤生物学的巨大变化方面至关重要,这将影响治疗方案和结果。”
研究人员表示,如果不与免疫疗法联合使用,谷氨酰胺酶抑制剂仍可能对一些患者有益。
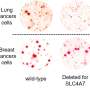
“我们发现KRAS和STK11/Lkb1突变组合的肿瘤产生了谷氨酸水平的升高,使肿瘤在临床前模型中茁壮成长,”Sutherland副教授说。
“因此,单独使用谷氨酰胺酶抑制剂对这种突变的患者是有益的。但将免疫疗法与抑制剂相结合不太可能产生积极的结果。”
该团队希望他们的工作将突出考虑模型系统的重要性,以检查肿瘤微环境的复杂问题,包括代谢谱和免疫功能免疫细胞.在设计复杂的联合疗法时,这一点尤其重要。
进一步探索