研究人员在细胞模型中阻止了17型脊髓小脑共济失调的进展
与阿尔茨海默病类似,17型脊髓小脑共济失调(SCA17)的遗传性疾病会导致脑神经细胞的破坏和患者的过早死亡。这种疾病的确切机制尚不清楚,这就是为什么目前还没有治疗方法。由Jonasz Weber博士领导的Ruhr-Universität波鸿人类遗传学部门的研究人员现在怀疑,一种称为calpains的蛋白质裂解酶可能在这种疾病中发挥作用。通过灭活calpain,研究人员能够在细胞模型中阻止疾病的进展。他们在杂志上发表了一篇关于他们发现的报告“细胞与分子生命科学”2022年4月28日。
改变了蛋白质的蓝图
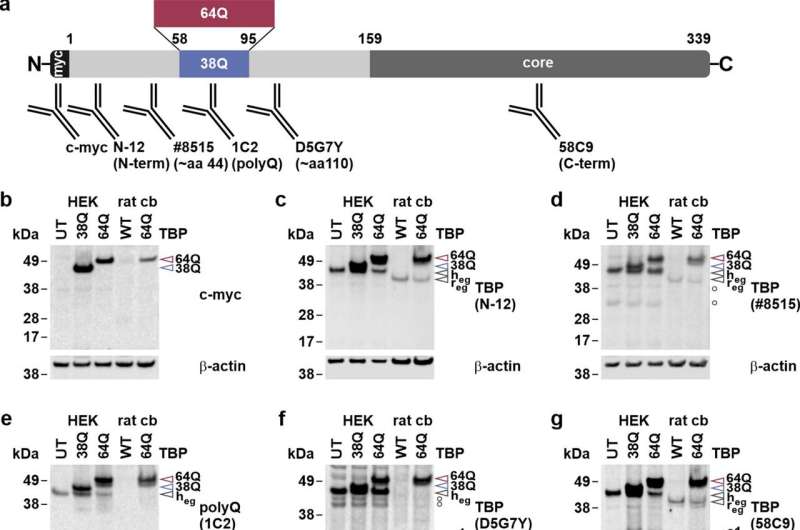
脊柱小脑性共济失调17型(SCA17)是一种罕见的,遗传性疾病人类大脑的一部分。由于含有一种叫做塔塔盒结合蛋白(TBP)的蛋白质蓝图的基因的病理改变,这种蛋白质在细胞中以异常构象产生。结果,它的功能受损。“这样做的一个结果是,这种蛋白质在大脑中形成可检测的蛋白质沉积物,并损害大脑神经细胞通过分子机制还没有被充分探索,”乔纳斯·韦伯解释道。
因此,受这种疾病影响的人开始出现症状中年,例如运动障碍癫痫发作、精神表现受损以及性格和行为的改变,这些都与小脑和脑干等组织的退化有关。
蛋白质片段沉积
引起这种疾病的分子机制尚不完全清楚。一种可能导致或至少影响该疾病的候选机制是某些酶对疾病蛋白TBP的切割。这种分裂导致神经细胞中产生更多有害的TBP蛋白片段。Jonasz Weber说:“值得注意的是,以前的研究表明,这些切割产物也出现在阿尔茨海默病患者的组织中,而且它们也可能在疾病的过程中发挥作用。”
钙平衡被打乱
由Huu Phuc Nguyen教授领导的来自波鸿人类遗传学系的团队现在已经证明了一种特殊的蛋白质裂解酶,即calpains,可以导致TBP的这种裂解。“此外,我们证明了这些酶在SCA17的细胞和动物模型中过度激活,”Jonasz Weber说。由于钙蛋白酶活性依赖于钙,这一发现表明基因参与控制钙钙平衡细胞的数量也可能失调。
通过药理学或遗传方法抑制酶,研究人员能够减少TBP的沉积和细胞模型中缺陷蛋白的产生。Jonasz Weber指出:“calpain参与SCA17疾病机制的证据为进一步研究铺平了道路。”后续研究应确定这一分子过程的相关性,并确定它是否以及如何可以被操纵。因此,这种疾病的治疗方法也可能出现。研究人员总结说:“这适用于SCA17以及类似的神经退行性疾病,在这些疾病中,钙痛在发病机制中起着至关重要的作用。”
进一步探索