抑制血管生成来治疗癌症
血管是人体的基本结构,它的存在是为了给细胞提供足够的营养和氧气。血管生成,或新血管的形成,在癌症医学中有很大的研究兴趣。由于肿瘤需要生成新的血管来生长,抑制血管生成被认为是一种有前途的治疗癌症的方法。
新生血管生成是指新生血管从原有的血管中形成的过程。新生血管生成的关键生物学过程涉及平衡“尖端”和“柄”内皮细胞(ECs)的形成。这个过程被称为尖端-柄规范。顶端ec具有高度运动性,有许多长而动态的丝状伪足,而柄ec具有高度增殖性,丝状伪足较少。这些功能不同的尖端和柄细胞协调成一个分枝的血管网络,用于新生血管的生成。
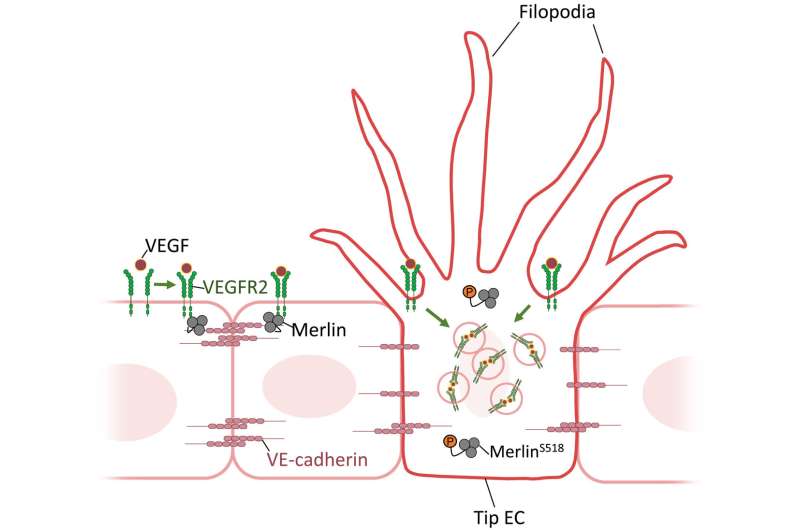
从形态学上看,叶尖EC诱导是血管新生的首要步骤。尖端ECs的形成是由一种叫做血管内皮生长因子(VEGF)-A(以下简称VEGF)信号通路。分子上,VEGFR2信号的细胞内激活是由配体诱导的、网格蛋白依赖的VEGFR2内化启动的。科学家们一直很好奇,一个特定的EC如何最终比它的邻居拥有更高的VEGFR2信号活性,并因此注定在血管新生过程中成为尖端EC。
在Bae Jung Hyun博士和Koh Gou Young教授的带领下,韩国大田基础科学研究所(IBS)血管研究中心的研究人员发现,一种名为Merlin的蛋白质在尖端EC诱导中不可或缺,它通过调节新生血管生成过程中细胞内VEGFR2下游信号。
梅林是由神经纤维瘤病2型基因NF2编码的,在相当长的一段时间内,人们已经知道它的功能是一种肿瘤抑制基因.它在所有类型的细胞中普遍表达,并作为一种膜相关蛋白,在细胞中起着把关作用信号转导以细胞密度依赖的方式从膜受体中提取。然而,内皮性梅林在新生血管生成中是否必不可少,以及细胞内的哪些信号是由内皮性梅林调节的,目前还没有研究。
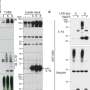
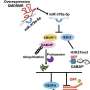
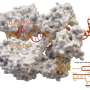
他们的研究发表在科学的进步,研究人员表明,EC在环境中的密度是关键因素。当比较低培养密度和高培养密度下Merlin在细胞中的定位和密度时,高细胞密度培养下Merlin能更好地与VEGFR2形成复合物。研究人员表明,这是因为VE-cadherin(一种细胞间连接蛋白)的存在是Merlin和VEGFR2相互形成复合物所必需的。Merlin-VEGFR2复合物的形成抑制了VEGFR2的内化,从而抑制了该途径。相反,在VE-cadherin密度相对较低的低密度ECs环境中,Merlin允许高水平的VEGFR2信号通路和ERK激活,从而导致尖端EC诱导(图1)。
研究人员通过研究Merlin的正常形态、非活性磷酸化形态(pMerlin (S518),即在丝氨酸518位点磷酸化的Merlin的缩写)和不能磷酸化的变体,研究了细胞密度对Merlin- vegfr2复合物形成的重要性。研究表明,Merlin在密集培养中与VEGFR2和VE-cadherin发生物理相互作用,其pMerlin水平较低(S518),但Merlin在稀疏培养中不发生这种相互作用,在培养ec中pMerlin水平较高(S518)。因此,Merlin和VEGFR2之间的相互作用依赖于pMerlin (S518),而pMerlin受细胞密度的调控。
“梅林在EC中的作用填补了新生血管生成的缺失部分。发芽血管生成应该通过梅林的促进和抑制信号的协调平衡来调节,”第一作者Bae Jung Hyun解释道。
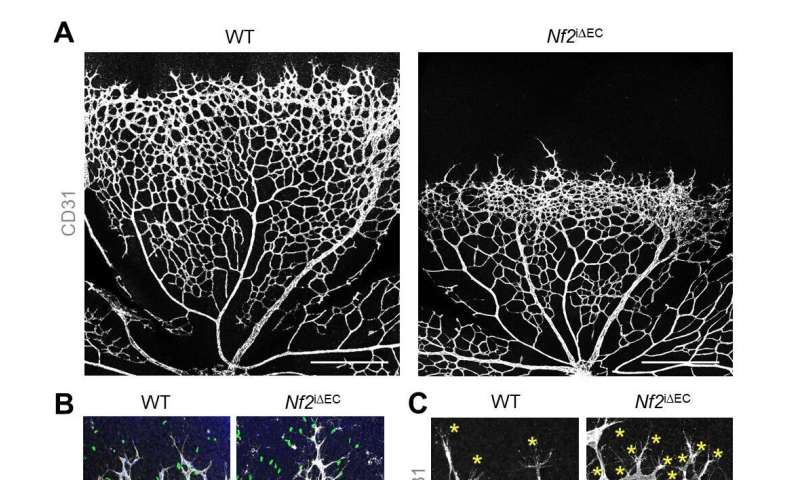
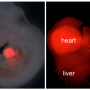
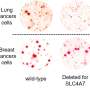
研究人员进一步证明,Merlin还通过抑制正常组织和肿瘤中成体血管中不必要的丝状伪足的形成和发芽,在维持毛细血管完整性和正常血管生成方面发挥着把关作用。当EC中的Merlin耗尽时,研究人员发现肿瘤模型中形成了过多的无功能血管,这促进了肿瘤坏死,减少了肿瘤生长。与正常小鼠相比,植入人类肺癌的梅林缺陷小鼠在3周后肿瘤生长减少了令人印象深刻的80.6%。同样,成年血管在甲状腺与野生型小鼠相比,merlin缺失小鼠小肠中丝状伪足的数量增加。
血管研究中心主任Koh Gou Young总结说:“我们的研究表明Merlin主要位于血管内皮细胞的细胞膜上,与VEGFR2和VE-cadherin相互作用,并通过抑制VEGFR2内化在VEGFR2细胞内下游信号传导中起负向作用。因此,内皮细胞Merlin可被视为一种看门调节剂,用于在出生后发育过程中视网膜新生血管生成的尖端EC诱导,成人成熟和建立的毛细血管EC中丝状伪足和芽的形成,以及肿瘤血管中尖端细胞的形成和适当的肿瘤血管构建。”