发现肝癌的新代谢途径,为新的治疗机会铺平道路
香港大学医学院临床医学院病理学系的研究人员发现了一种新的肝癌细胞代谢机制,即大胞饮(macropinocytosis),一种内吞过程,用于吞噬细胞外蛋白质作为燃料,以支持肝细胞癌(HCC)在缺氧(缺氧)下无限生长。
这一发现表明,靶向大胞饮症可能是一种新的有效的HCC治疗方法。研究结果已发表在自然通讯。
HCC是最常见的原发性肝癌肝癌。在香港,肝细胞癌是第五常见及第三致命的癌症。尽管治疗方法越来越多,但中晚期HCC患者的平均预期寿命仍不足两年。
血液提供氧气,这是HCC的重要营养物质。然而,氧含量在实体肿瘤包括HCC在内,由于肿瘤生长速度异常高,通常低于正常器官,远远超过血管的生长速度。HCC细胞对缺氧因为它们通过稳定一种称为缺氧诱导因子-1 (HIF-1)的转录因子,对这种“营养应激”具有高度的适应性。
香港医学大学的研究发现了一种新的基因,EHD2,由HIF-1调控,它激发了依赖于大胞吞的代谢程序,以促进HCC细胞在“营养应激”下适应和增殖。该研究还表明,治疗靶向大胞饮通路可以有效地抑制HCC。
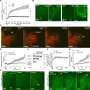
大胞饮是一种允许细胞吞噬细胞外蛋白质的内吞途径。通过共焦显微镜,结果表明,缺氧可使HCC细胞表现出5-10倍的大细胞诱导水平。通过质谱分析,研究小组亦发现,被吞噬的蛋白质被消化并降解为氨基酸,从而成为支持肝癌细胞增殖的燃料。
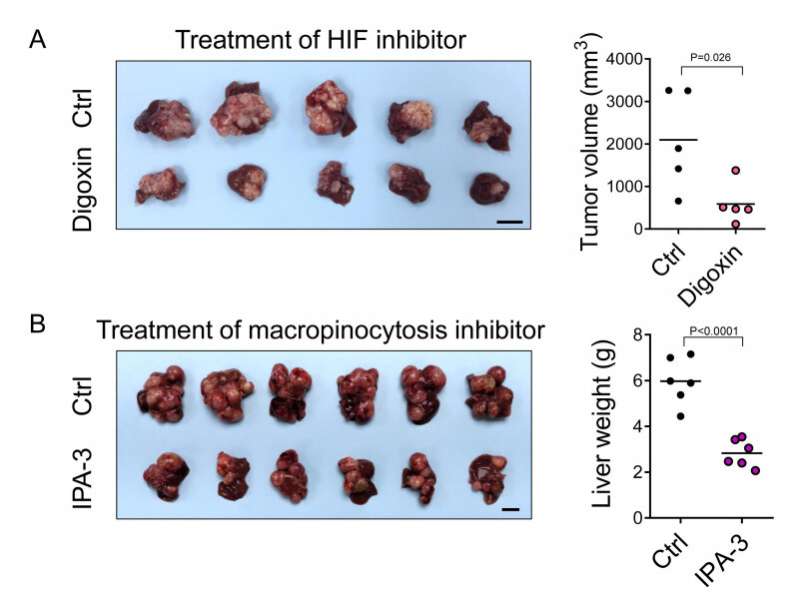
这一过程是由HIF-1介导的,它通过转录激活一种名为EH结构域含蛋白2 (EHD2)的新基因,驱动膜褶的形成,是大胞饮的第一步也是关键的一步。EHD2在小鼠中的缺失阻止了HCC的发展。在小鼠HCC模型中,HIF抑制剂、地高辛或大胞饮抑制剂- ipa -3的治疗也实现了50%以上的肿瘤负荷抑制。
更重要的是,在约40%的HCC患者中,EHD2显著过表达至少2倍。综上所述,该研究表明HIF-1/ ehd2介导的巨胞增多支持HCC的生长。抑制大胞饮是HCC的有效治疗方法。
“肝癌预后差,部分原因是它的癌症细胞聪明到能在贫瘠的环境中生存。因此,了解肝癌的生物学及代谢机制,是找出有效治疗靶点及治疗方法的基础。”港大临床医学院病理学系副教授黄嘉蕾博士说。
“在这项研究中,我们发现肝癌细胞将开始适应一种不同寻常的代谢程序,从环境中清除蛋白质作为营养来源。此外,发现的HIF-1/EHD2通路支持大胞饮介导的癌症代谢重编程,为设计针对大胞饮的创新癌症治疗策略提供了重要的分子基础。需要注意的是,缺氧并不局限于肝癌,而是所有实体癌。因此,我们的发现也适用于其他类型的癌症。”
进一步探索