对老鼠的研究描述了大脑中不同类型的细胞如何共同抑制恶心
对人体来说,恶心是一种无所不包的感觉:从怀孕、偏头痛到吃坏了的食物或接受化疗,不愉快的恶心感觉都可能袭击我们。
然而,尽管它无处不在,科学家们仍然无法确切了解其原因恶心想吐在机械层面上工作。
现在,由细胞生物学家哈佛医学院的研究在加深我们对癌症的理解方面取得了长足的进步大脑控制恶心的途径。
在6月14日发表的一项小鼠研究中细胞的报道科学家们描述了一种机制,通过这种机制,特定大脑区域的抑制性神经元会抑制引起恶心的兴奋性神经元的活动,从而抑制恶心。
这项研究揭示了恶心的基本生物学原理。如果在动物和人类的进一步研究中得到证实,这将有助于开发更好的抗恶心药物。
调解问题
当我们摄入毒素或感染时,恶心促使我们呕吐,从而帮助我们生存。然而,当恶心在其他情况下发生时——例如,在怀孕期间或作为癌症或糖尿病治疗的副作用——就会成为一个大问题。如果不及时治疗,无法控制的呕吐会导致电解质失衡,在极少数情况下,还会导致危及生命的脱水。目前治疗与这些症状相关的恶心的药物并不都那么有效,这在很大程度上是因为科学家们对大脑如何产生这种感觉没有详细的了解。
“在我们了解恶心的机制之前,我们无法真正开发出更好的治疗策略,”第一作者、HMS细胞生物学研究员Chuchu Zhang说。
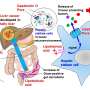
张和HMS Blavatnik研究所的细胞生物学教授、资深作者Stephen Liberles正在研究脑干中一个被称为“后rema区”的区域,该区域似乎与恶心有关。
早期的研究发现,刺激大脑的这一区域会诱导呕吐,而禁用它会减少恶心,“但它是如何在恶心中发挥作用的尚不清楚,所以我们认为这将是一个很好的起点,”张说。
在一个2020年的研究在神经元, Zhang和Liberles在死后区发现了引起恶心的兴奋性神经元,以及它们相关的受体。具体来说,他们表达GLP1受体的特征神经元的一种蛋白质血糖和欲望控制。他们指出,这种受体是糖尿病药物的常见目标,而恶心是糖尿病药物的主要副作用。
当带有GLP1受体的神经元被打开时,小鼠表现出恶心的迹象,当神经元被关闭时,恶心行为停止。研究小组还绘制了这些引起恶心的神经元的图谱血脑屏障这使得他们可以很容易地检测到血液中的毒素。
张说:“了解什么受体在死后的区域表达,可以告诉我们恶心信号通路可能涉及什么类型。”
Liberles补充说:“干预恶心的一种传统方法是使用药物抑制剂阻断这些信号通路。”
然而,研究人员想知道是否有另一种减少恶心的方法——一种专注于抑制神经元的方法,抑制死后该区域的兴奋神经元。
另一个路径
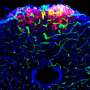
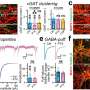
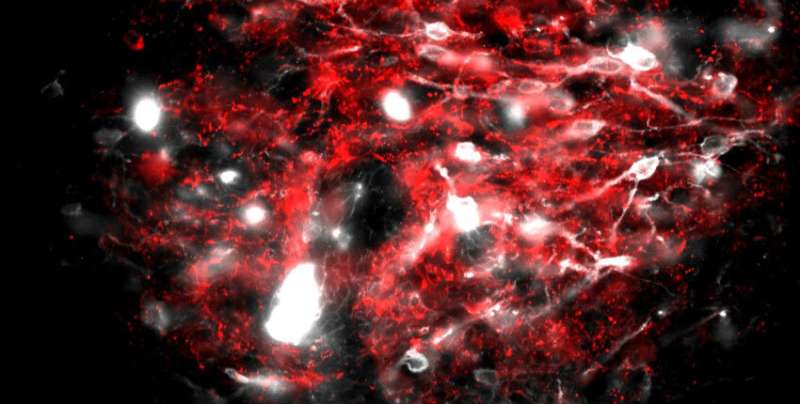
在新的研究中,研究人员探索了死后区域抑制性神经元的结构和功能。对这些神经元的映射显示,它们形成了一个密集的网络,与附近的兴奋性神经元相连。当研究人员激活这些抑制性神经元时,小鼠停止了通常由兴奋性神经元引起的恶心行为。
深入研究后,研究小组发现了三种类型的抑制神经元。其中一种表达GIP的受体,GIP是消化系统在进食后释放的一种小蛋白质,刺激胰岛素的释放以控制血糖。
张说:“我们很好奇,这种由GIP受体标记的抑制神经元是否可以被操纵来抑制恶心行为,以及这一机制是如何工作的。”
当研究人员使用GIP激活这些抑制性神经元时,由化学信使GABA引发的抑制性电流流向附近的兴奋性神经元,降低了它们的活性。在行为水平上,给予小鼠GIP激活这些抑制神经元可以消除恶心行为。另一方面,当抑制神经元被破坏时,即使在接受GIP后,小鼠仍继续表现出恶心的迹象。
张说,因为老鼠不会呕吐,所以这项研究依赖于观察恶心行为的存在,比如避免接触有毒物质。鉴于人类也存在同样的大脑通路,研究人员表示,这种机制可能是保守的。
Liberles解释说:“通过识别在药理学上可触及的大脑区域抑制恶心的抑制神经元,我们可以简单地激活这些神经元来对抗恶心反应。”
“死后区域的脑干抑制神经元可能是抗恶心药物开发的一个重要临床靶点,”张说。“这绝对是开发抗恶心疗法的新策略。”
张说,GIP已经被研究为一种治疗恶心的潜在疗法。事实上,初步研究表明,给予GIP或激活GIP受体可以减轻呕吐动物的恶心感,包括雪貂、狗和鼩鼱。科学家们目前正致力于将GIP纳入针对GLP1受体的糖尿病治疗中,目的是减少恶心作为副作用。
张和Liberles计划继续探索恶心的基本生物学,包括大脑中的抑制性神经元是如何被自然激活的,以及大脑中哪些区域参与了控制它们的活动。研究小组还想研究其他的受体抑制性神经元以及吸引它们的各种信号因素。
“因为引发恶心的方式不同,可能涉及不同的受体和信号因子,可以用作抑制恶心的药物靶点。”张说。“我们想了解更多关于各种恶心机制的知识,这样我们就可以针对具体情况制定更好的治疗策略。”
进一步探索