类器官显示肌强直性营养不良1型和Rett综合征之间的相似性

肌强直性营养不良1型(DM1)是肌肉营养不良最常见的一种形式,其特征是进行性肌肉萎缩和无力,由异常重复的DNA片段转录成有毒的RNA分子引起。这些RNA分子不是将基因的指令转译成蛋白质,而是在细胞中积累,扰乱细胞的运作。
雷特综合征(RS)是一种罕见的影响大脑发育的遗传神经系统疾病,导致早期运动技能和语言能力的逐渐丧失。
发表在2022年6月29日的在线期刊上科学转化医学加州大学圣地亚哥医学院(University San Diego School of Medicine)的研究人员使用了三维大脑器官——从中生长出的自组织组织干细胞模拟神经功能——发现DM1和RS之间的基本相似之处,或许还能找到治疗的机会。
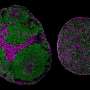
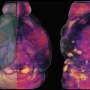
第一作者Kathryn Morelli博士说:“我们转向模拟发展中的人类皮层的3D大脑器官,来研究CTG重复膨胀对神经元过程的影响。”Kathryn Morelli博士是资深作者Gene Yeo博士的实验室成员,细胞和神经科学教授分子医学加州大学圣地亚哥医学院。
“这种模型可以由携带这些有毒RNA聚集物的真正DM1患者的诱导多能干细胞系制成。它模仿了子宫内皮质的发育。”
与其他类型的肌肉萎缩症不同,DM1患者经常表现出渐进性的神经认知症状,其学习和社交障碍可能与自闭症谱系障碍类似。最近的临床数据表明,遗传DNA重复次数越多,症状出现的时间就越早,疾病对中枢神经系统的影响就越大。
现代DM1治疗只针对骨骼和心肌缺陷。Yeo及其同事的研究表明,RNA靶向CRISPR/Cas蛋白可以与活人类细胞中的重复RNA结合,并逆转DM1小鼠骨骼肌中的疾病标记物。
Morelli说:“尽管如此,人类大脑细胞模型的缺乏限制了我们对有毒RNA如何导致认知症状的理解,并阻碍了开发有效的整体疗法的努力。”
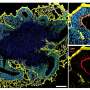
在最新的研究中,研究人员将一种紧凑的rna靶向CRISPR/Cas蛋白包装成病毒载体,然后将其添加到DM1脑类器官中。他们发现,这些蛋白质破坏了有毒的RNA聚合体,科学家能够观察和控制这一系列事件。
该团队专注于一个模型,在这个模型中,有毒的RNA捕获了一种被称为RNA的特殊蛋白质结合蛋白,即rbp。Yeo说:“在皮质类器官中,我们惊讶地发现另一种叫做CELF2蛋白的RBP在谷氨酸能神经元中出现了失调,而谷氨酸能神经元负责大脑中的兴奋信号。”
利用实验室首创的增强交联和免疫沉淀技术,Morelli和同事们发现CELF2不能结合其正常的靶基因:甲基- cpg结合中的基因蛋白质2 (MECP2)通路对神经元功能至关重要。导致MECP2正常功能丧失的突变会导致RS。
Morelli指出,临床试验正在评估n -甲基-d-天冬氨酸(NMDA)拮抗剂治疗RS患者的潜力,NMDA受体被认为在控制突触可塑性和调节学习和记忆功能方面很重要。
在DM1类器官中,Morelli发现NMDA拮抗剂逆转了疾病的主要特征,提示靶向NMDA受体可能改善年轻DM1患者的认知障碍,并显著提高他们的生活质量。
共同作者包括金文豪、Shashank Shathe、Assael A. Madrigal、Krysten L. Jones、Joshua L. Schwartz、Tristan Bridges、Jasmine R. Mueller、Archana Shankar、Isaac A. Chaim,均来自加州大学圣地亚哥分校;以及斯坦福大学的John W. Day。