干细胞模型可以帮助解开一些精神疾病背后的复杂生物学
西奈山伊坎医学院的研究人员应用了一种新的干细胞模型来绘制人类神经元中的疾病风险变异,这可能有助于深入了解自闭症和精神分裂症等神经精神障碍的生物学机制。
该团队的体外细胞模型,在5月31日的《细胞的报道,旨在使未来的研究人员能够阐明涉及的疾病机制全基因组关联研究(GWAS),描述不同的风险等位基因(常见的遗传变异赋予风险)的精神障碍。这项研究可能会改善诊断方法,在患者出现症状前几年就能发现精神障碍。
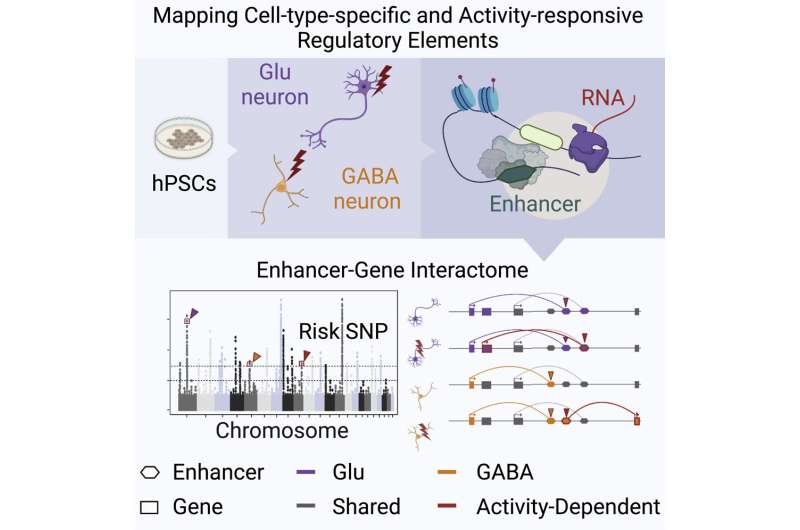
研究的重点是映射顺式监管元素与精神疾病的遗传性有关顺式调控元件,如启动子和增强子,是非编码DNA序列调控元件基因表达因此是基因调控网络的重要组成部分。先前的遗传学研究已经揭示了顺式调节元件中常见变异的显著富集,包括那些与自闭症谱系障碍、精神分裂症和双相情感障碍相关的变异。
“虽然常见的风险变异可以揭示潜在的分子机制,但对科学家来说,识别因果变异仍然具有挑战性,”西奈山伊坎医学院神经科学助理教授、该研究的高级作者Nan Yang博士说。“这是因为顺式调控元素,尤其是增强剂,各不相同细胞类型和活动状态。通常,研究人员只能使用神经元不再活跃的死后大脑样本。因此,他们很可能会错过只对刺激有反应的增强子。我们的方法是在多能干细胞衍生的人类神经元中绘制顺式调节元件。这使我们能够复制人类大脑中可能受到不同类型神经精神疾病影响的神经元,并对其他类型的人类样本无法获得的人类遗传变异进行机制研究。”
近年来,GWAS已经确定了数百个与精神疾病相关的基因区域,尽管对疾病病理生理学的理解一直是难以捉摸的。的功能基因组学杨博士和她的团队开发的方法使用干细胞模型,可以帮助解决跨细胞类型、遗传背景和环境条件的患者特异性变异的影响。这种独特的方法有效地奠定了将风险变异转化为基因、基因转化为途径、途径转化为回路的基础,揭示了大脑中疾病风险因素之间以及细胞类型之间的协同关系。
“我们的研究试图解码并将高度复杂的遗传见解转化为医学上可操作的信息,”杨博士说,他是布莱克家族干细胞研究所、弗里德曼大脑研究所和西奈山卫生系统内罗纳德·m·勒布阿尔茨海默病中心的成员。“这意味着提高我们的诊断能力,预测临床轨迹,并确定精神疾病治疗干预的症状前点。”
通过描述人类细胞来源神经元中的细胞类型特异性和活性调控基因表达模式,杨博士相信她的团队的研究可以极大地造福研究界。她指出:“我们的数据可以指导选择相关细胞类型的实验条件,以进一步阐明整个基因组疾病的分子机制。”“这可能会导致生物标志物的发展,可以检测到神经精神障碍在它们出现在患者身上之前还有很多年,而我们仍然有时间来延迟或可能预防它们。”