有毒蛋白“变体”可能是ALS疗法的下一个靶标
长期以来,科学家知道蛋白质可以在阿尔茨海默氏病,帕金森氏病和肌萎缩性侧索硬化症(ALS)等神经退行性疾病中形成有害簇。但是,宾夕法尼亚州立大学研究人员的一项新研究表明,与ALS病理学形式有关的蛋白质的“变体”复合物在单独的途径中,这一发现可能使药物开发人员更容易设计疗法以靶向更有害的变体。
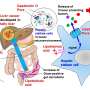
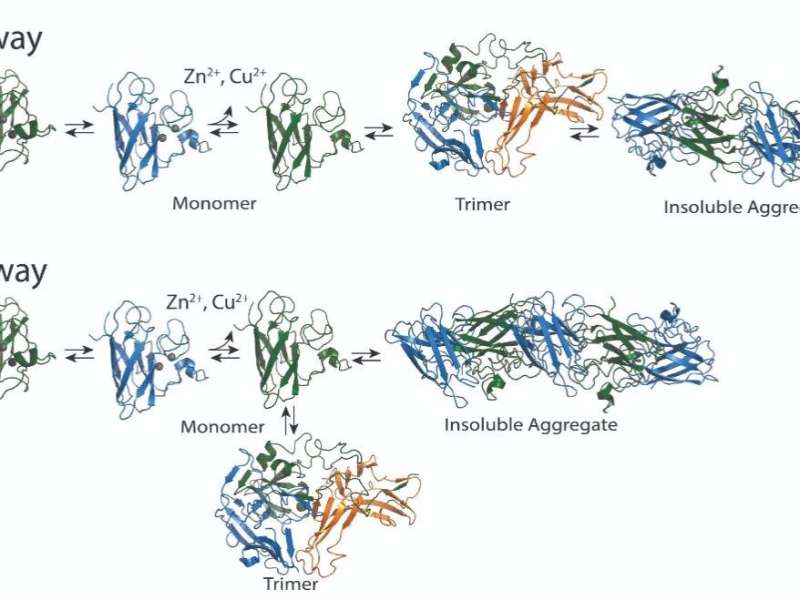
超氧化物歧化酶(SOD1)是一种有助于ALS发育和进展的聚集蛋白,尽管目前尚不清楚它使用哪种生物学机制来做到这一点。该蛋白的突变已与15-30%的家族性ALS病例和1-2%的自发性ALS病例有关。通常存在于两部分的二聚体中,SOD1铜或锌离子的损失会导致其分为两个单独的单体或单位。单体可以形成三部分形式或三部分形式,也可以成骨形成较大的原纤维,这些原纤维由许多SOD1单体组成。先前的研究表明,三聚体形式对细胞有毒。其他研究表明,较大的骨料形式实际上可能具有保护功能。
确定较大骨料的形成是否需要的三聚体或与骨料的形成竞争是否可以帮助确定治疗策略。Nikolay Dokholyan,G。ThomasPassananti教授兼宾夕法尼亚州立医学院药理学系研究副主席,以及宾夕法尼亚州立大学工程学院生物医学工程学系的研究生Brianna Hnath,通过其工作,他们的工作发现三聚体以与较大骨料的单独竞争路径开发。
Hnath说:“确定三聚体的形成是否与大型骨料开发分开或一部分可能会影响我们药物治疗ALS这样的疾病的方式。”“当前的治疗剂专注于分解大骨料,但是在骨料骨料具有保护性的情况下,最好专注于靶向三聚体形成。”
Hnath和Dokholyan设计了稳定的SOD1三聚体突变体并使用神经元样细胞模型,发现稳定的SOD1三聚体增加了细胞死亡。他们还确定,稳定三聚体可以防止细胞模型中的原纤维形成。这一观察结果使他们进行了色谱实验,发现SOD1三聚体直接与原纤维竞争 - SOD1单体的Large络合物。
最重要的是,研究人员确定三聚体结构独立于较大的聚集体形成,这证实了三聚体的形成不是建造SOD1原纤维聚集体的途径的一部分。结果发表在生物物理杂志。
Dokholyan说:“这一发现很重要,因为它向我们表明,ALS的治疗策略可以集中精力抑制有毒三聚体的形成,而不是针对纤维骨料的骨料,例如某些阿尔茨海默氏症的药物。”和分子生物学,,,,生物医学工程,宾夕法尼亚州立癌症研究所和宾夕法尼亚州立神经科学研究所的化学和研究人员。“较小的低聚物在ALS中有毒的事实是一种相对较新的理论,仍然需要进一步的探索和验证。”
Dokholyan和Hnath计划进行研究,以更好地了解SOD1三聚体的结构以及如何蛋白质蛋白质相互作用与三聚体有关的有助于ALS的发展和进展。
进一步探索