铜会导致蛋白质聚合在帕金森病

铜暴露在环境中,蛋白质的α-突触核蛋白在人类的大脑可以发挥重要作用在帕金森病的发病机制。电子探针和利默里克大学的一个小组展示了蛋白质形成成一个不寻常的形状暴露在大量的铜离子。发表在ACS的化学神经科学,这些发现可能有助于开发治疗神经退行性疾病的新策略。
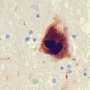
帕金森病的病因尚未完全了解。很久以前发生的典型肌肉震颤、缺陷的出现在大脑中蛋白质可能是第一个迹象。电子探针和利默里克大学的研究人员在爱尔兰现在已经仔细看看这些α-突触核蛋白的形状异常蛋白质的戒指。在这一过程中,他们也能够想象在纳米尺度上的连接环境污染由铜。这启示了神经退行性疾病的发展和biometals疾病过程中所扮演的角色。此外,这一发现可以提供机会来改善疾病的早期检测和治疗。
可疑的金属
了解帕金森病是大脑神经元死亡,导致神经递质多巴胺的不足。在疾病的后期,这导致肌肉震颤,肌肉僵硬,甚至不动。慢慢进步的疾病是世界上第二个最常见的神经退行性疾病后,阿尔茨海默氏症。环境因素如杀虫剂或金属可以促进帕金森病的发生。
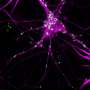
团队领导的电子探针传输在纳米尺度界面实验室的研究员彼得Nirmalraj正在调查这一假设使用成像技术和化学光谱法以及与团队合作的达米安•汤普森在利默里克大学,计算机模拟。研究人员针对蛋白质,参与几个分子过程在帕金森病的发展:α-突触核蛋白。在受影响的个人,这种内源性蛋白质聚集在一起,导致神经细胞死亡。研究人员怀疑,高浓度铜干扰这些流程和加速疾病的过程。
邪恶环
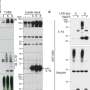
可视化的α-突触核蛋白的凝结纳米尺度电子探针研究员西尔维亚冠军纤维素和木质材料实验室人工产生的蛋白质。使用原子力显微镜,研究人员可以观察蛋白质,最初的解决方案,在一段时间内的十天形成个人不溶性丝状结构,最后聚集在一起形成一个致密的纤维网络。基于图像,可溶性蛋白质的转换为集群分布纤维长度应该在1微米左右,当他们出现在疾病的进展,可以在实验室观察与令人印象深刻的精度。
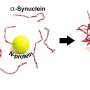
如果研究人员然后添加铜离子的蛋白质溶液,完全不同的结构出现在显微镜下:环形7纳米大小的蛋白质结构,所谓的寡聚物,出现在试管内只有几个小时。这些环形低聚物及其破坏细胞效应的存在已经知道。更重要的是,时间越长联结构出现早于copper-free解决方案。
“一方面,高剂量的铜似乎加速聚合过程,”Peter Nirmalraj说。此外,然而,这种不同寻常的环形蛋白质结构发展相对迅速的影响下铜,这可能标志着病理过程的开始,甚至触发它。研究人员还分析了绑定的铜离子的α-突触核蛋白在微小的步骤使用分子动力学计算机模拟10 100纳秒。
早期测试
因为低聚物环是在刚开始的时候形成的蛋白质转换,戒指可以作为新形式的治疗目标,Nirmalraj希望。此外,这一发现可以帮助促进帕金森病的发展测试可以检测到疾病处于初级阶段体液例如,使用样本脊髓液。
进一步探索