新的DNA修复试剂盒成功修复患者来源细胞中的遗传性疾病
一种可能改变游戏规则的DNA修复试剂盒已经在患者来源的肾细胞中修复了导致儿童和年轻人衰弱性遗传性肾病的基因突变。由布里斯托尔大学的科学家们开发的这一进展发表在《科学》杂志上核酸研究.
在这项新的研究中,这个国际团队描述了他们如何创造出一种DNA修复载体来从基因上修复有缺陷的podocin,这是遗传性类固醇耐药性肾病综合征(SRNS)的一种常见遗传原因。
Podocin是一种通常位于特化表面的蛋白质肾细胞对于肾脏功能.然而,有缺陷的podocin仍然停留在细胞内,永远不会到达表面,最终破坏足细胞。由于这种疾病不能用药物治愈,基因疗法可以修复基因突变导致有缺陷的podocin给患者带来了希望。
通常,人类病毒已在基因治疗应用中用于进行基因修复。它们被用作“特洛伊木马”,进入携带错误的细胞。目前占主导地位的系统包括慢病毒(LV)、腺病毒(AV)和腺相关病毒(AAV),它们都是相对无害的病毒,很容易感染人类。然而,这些病毒都有相同的局限性,即它们被限制在病毒壳内的空间内。这反过来又限制了它们所能运送的货物的数量,即有效基因修复所需的DNA试剂盒,这大大限制了它们在基因治疗中的应用范围。
布里斯托生物化学学院的Francesco auicino博士和Imre Berger教授领导的研究小组应用合成生物学技术,重新设计了杆状病毒,这是一种对人类无害的昆虫病毒,不再受到运载能力有限的限制。
领导这项研究的弗朗西斯科·奥利奇诺博士说:“杆状病毒与LV、AV和AAV的区别在于缺乏包裹货物空间的坚硬外壳。”杆状病毒的外壳就像一根中空的棍子——当装载物增加时,它就会变长。这意味着需要更复杂的工具来修复遗传缺陷可以通过杆状病毒传播,使其比常用的系统更加通用。
首先,杆状病毒必须具备穿透人体细胞的能力,而这在正常情况下是无法做到的。“我们用蛋白质修饰了杆状病毒,使其能够非常有效地进入人类细胞,”auicino博士解释说。这种改良的杆状病毒被认为是安全的,因为它只能在昆虫中繁殖,而不能在人类细胞中繁殖。然后,科学家们利用他们的工程杆状病毒传递比以前可能的更大的DNA片段,并将其构建到一系列人类细胞的基因组中。
人类基因组中的DNA由30亿个碱基对组成约25.000个碱基对基因它们编码对细胞功能至关重要的蛋白质。如果我们的基因中出现了错误的碱基对,就会产生错误的蛋白质,从而使我们生病,导致遗传性疾病。基因疗法有望通过纠正我们基因组中的这些错误,从根本上修复遗传性疾病。基因编辑方法,特别是基于CRISPR/ cas的方法,通过实现碱基对精度的基因修复,极大地推动了该领域的发展。
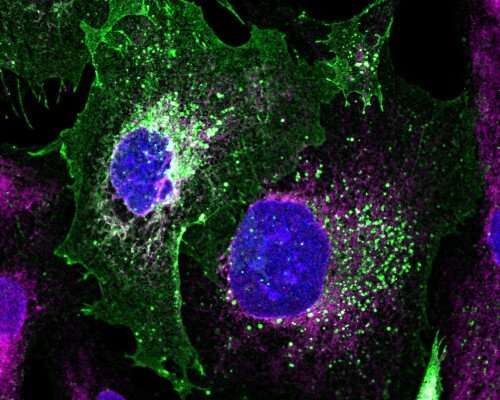
该团队使用患者来源的足细胞在基因组中携带致病错误来证明他们的技术能力。通过创建DNA修复试剂盒,包括基于蛋白质的剪刀和引导它们的核酸分子,以及替换有缺陷基因的DNA序列,该团队用单个工程杆状病毒提供了一个健康的podocin基因副本,并伴随着CRISPR/Cas机器,以碱基对精度将其插入基因组。这能够逆转致病表型,并将podocin恢复到细胞表面。
Imre Berger教授解释说:“我们以前使用杆状病毒感染培养的昆虫细胞,以产生重组蛋白,以研究它们的结构和功能。”这种方法被称为MultiBac,由伯杰实验室开发,在世界各地的实验室中都非常成功地制备了具有许多亚基的非常大的多蛋白复合物。“MultiBac已经利用杆状病毒外壳的灵活性,将大片段的DNA传递到培养的昆虫细胞中,指导它们组装我们感兴趣的蛋白质。”当科学家们意识到同样的特性可能会改变人类的基因治疗细胞之后,他们开始着手创建他们在出版物中描述的新系统。
奥利奇诺博士补充说:“有很多途径可以利用我们的系统。除了podocin修复,我们可以证明我们可以同时纠正许多错误在非常不同的地方通过使用我们的单一杆状病毒传递系统和最新的可用编辑技术,有效地在基因组中进行编辑。”
“SRNS是影响肾脏的更常见的遗传疾病之一”,该领域的权威专家Moin Saleem教授说基因治疗的遗传性肾病布里斯托肾医院。“SRNS的特征是早期肾衰竭,导致患者生活质量严重下降。”
布里斯托肾大学肾细胞生物学教授加文·威尔士教授总结道:“这些结果非常令人鼓舞。Berger团队开创的这种新方法不仅对SRNS有希望,而且对一系列其他肾脏遗传疾病也有希望,这些疾病的有效基因修复用目前的技术是不可行的。实现临床应用的新载体系统还有很长的路要走,但我们相信所提供的优势使其成为一项非常值得的事业。”
进一步探索