许多药物作用于体内的多个靶点:一些药物设计者接受了“副作用”
药物并不总是像预期的那样起作用。虽然研究人员可能会开发一种药物来执行一种特定的功能,可能是为特定的基因图谱量身定制的,但有时这种药物可能会执行几项预期目的之外的其他功能。
这种药物具有多种功能的概念,叫做多重药理学,可能会导致意想不到的后果。这是常见的情况癌症药物的临床试验可以有有害副作用和治疗毒性.
但事实上,多药理学可能是大多数药物的常态,而不是例外。所以与其看到药物它具有多种功能的能力是一个缺陷,像我这样的生物医学数据科学家和我的实验室的同事相信它可以被用来为我们的优势设计药物,以解决生物的全部复杂性。
药物经常在细胞中进行多任务处理
当科学家们谈论药物时,他们喜欢提到它作用机制,简称MOA从本质上讲,就是药物进入人体后的作用。然而,一种药物的官方MOA可能并不包括它影响细胞的所有方式。
例如,一种标签为a的药物的作用机制VEGF抑制剂是阻止细胞内一种叫做VEGF的蛋白质的活性,也就是血管内皮生长因子。虽然VEGF在生成新血管方面发挥着重要作用,这是健康组织发育不可或缺的过程,但它也可能是一种疾病癌症的标志.阻断VEGF能阻止形成吗新生血管为肿瘤提供营养,防止多种癌症的生长和扩散。
目前有14种抑制新血管形成的药物被美国批准用于治疗癌症,大多数靶向VEGF。你可能想知道为什么有那么多不同的药物,如果它们都抑制同一种蛋白质。答案可以归结为多药理学:虽然它们都很可能以某种方式阻断VEGF,但每种药物可能都有其独特的其他功能。这种替代功能可能会产生副作用,或者只在某些条件下有效。
VEGF属于一个更大的蛋白质组,叫做受体酪氨酸激酶,简称rtk,单独针对这些目标是很有挑战性的。许多针对一种RTK的药物,如VEGF,也会不加区分地终止瞄准其他rtk因为他们共享相似的化学结构,可能会导致不必要的副作用。
例如,1999年,科学家发现臭名昭著的晨吐药沙利度胺也可以作为VEGF抑制剂治疗多发性骨髓瘤这是一种血癌。这是一种药物的胜利,而仅仅在70年前,这种药物因估计导致严重的出生检测而在世界范围内被禁止10000名婴儿不包括流产和死产。
就像萨力多胺一样,许多化学物质会以不同的方式影响身体,它们的作用机制仍未完全了解。甚至一些被批准的药物,如锂,对乙酰氨基酚和许多抗抑郁药仍然有一个不清楚恐鸟.
关于多药理学的意外发现,也许最著名的例子是伟哥这种药物最初是为了心血管疾病但后来被批准用于治疗勃起功能障碍。有趣的是,越来越多的证据表明伟哥也可以作为一种VEGF活化剂这可能有助于治疗中风或心脏病发作。
利用多药理学的优势
问题是,当你服用一种具有多种功能的药物时,你无法将一种预期效果与其他效果分离开来——你必须同时获得所有效果。研究人员对多药理学的反应有两种方式。科学家可以尝试设计更好的药物,只针对一个特定的靶点。或者,科学家可以转而拥抱生物的复杂性,并尝试利用药物可以提供的多面效应。
许多现有的药物具有未知的机制,可以作为一种优势而不是劣势加以利用。研究人员可以使用多药理学来改变现有药物的用途,用于其他疾病,减少开发新疗法的时间和成本。现在有一整个行业的医生和科学家都在试图做到这一点。化学家和药物设计者也是有目的的设计具有多种功能的药物以对抗复杂的疾病,如癌症和2型糖尿病,这些疾病可能有多个靶点,可以逃避单一功能的治疗。
但是为了利用现有药物的多药理学,研究人员需要一种方法来测量它。通常,化学家通过费力的实验来研究药物机制,每次只测试一种药物,并不总是能得出决定性的答案。然而,新的实验方法,比如表型药物筛选这种方法可以让研究人员在一次实验中测量数千种不同的药物,而不是试图缩小其作用机制。
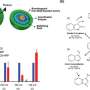
我和我的同事们用这种方法来预测特定药物的所有效果,只使用细胞图像。我们收集了1.59亿张细胞对1300多种不同药物反应的快照,然后应用机器学习算法识别图像中的重要模式。我们没有教算法寻找特定的细节,而是让它在图片中搜索数据片段,从而更好地预测细胞对不同类型药物的反应。
我们的模型改变了一种叫做潜空间算法,最初是利用人脸图片来预测多药理学的药物。就像最初的算法可以模拟一个戴眼镜的人的照片一样,我们可以模拟一个细胞在被具有多种作用机制的药物治疗后的样子。
然而,我们的模型远非完美。许多药物的作用机制不能很好地模拟,而且我们受到现有的(可能是不完整的)关于不同药物如何起作用的知识的限制。在更广泛的背景下揭开不同药物机制如何影响细胞的神秘面纱,有助于改善对药物所有潜在功能的预测,从而为每种化合物提供更多的治疗可能性。
我相信,将多药理学作为使用药物治疗疾病的一个不可避免的结果,可以帮助研究人员重新想象药物的发现过程。我们能否设计出一种针对特定患者肿瘤中所有失控受体的药物?我们能用人工智能来模拟这种潜在的药物化合物在体内的样子和行为吗?多药理学真的能成为精准医疗的答案,而不是最大的挑战之一吗?思维方式的转变可能是回答这些问题的第一步。