科学家使用迷你肾脏模型来确定治疗多囊肾病的潜在药物
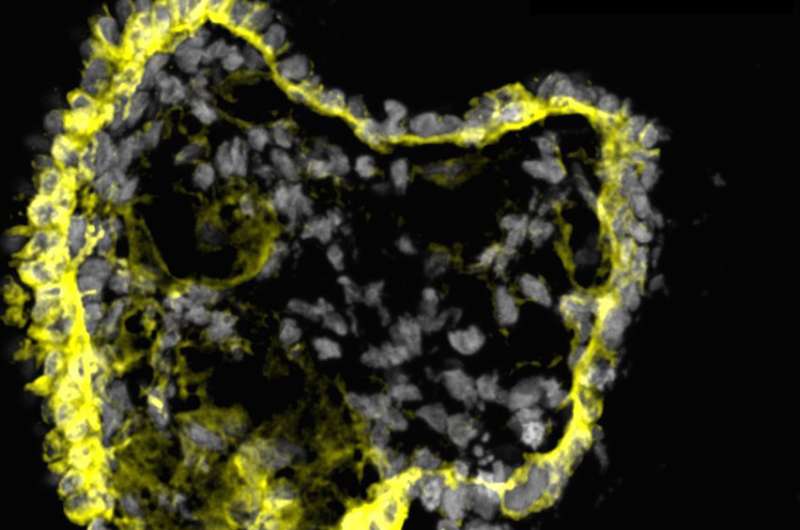
在一项新的研究中细胞干细胞来自南加州大学安迪·麦克马洪(Andy McMahon)实验室的科学家们生成了被称为类器官的简单肾样结构,并利用它们来确定治疗成人多囊肾病的潜在药物。
影响着全球八百万患者,成人发病形式的多囊肾疾病遵循所谓的“常染色体显性”遗传模式——这意味着当一个人继承了一个坏的基因副本时,这种疾病就会发生PKD1或PKD2,第二个好的副本的活动也丢失了。常染色体显性多囊肾病(ADPKD)在肾脏的许多区域引起充满液体的大囊肿,导致肾功能丧失和影响肝脏、胰腺和心脏的其他危及生命的并发症。Tolvaptan是FDA唯一批准的治疗ADPKD的药物,它能减缓但不阻塞疾病进展并且只在由特定肾细胞类型组成的囊肿子集中起作用。
为了加速寻找ADPKD的新疗法,第一作者Tracy Tran, Cheng (Jack) Song和他们的同事从人类多能干细胞它们要么有能力繁殖,要么有能力生产更多干细胞或者分化成许多不同类型的专门化细胞.他们用这些多能干细胞生长由一到两个类似肾脏过滤单元的结构组成的类器官,称为肾元。
McMahon教授是该研究的第一作者,干细胞生物学和再生医学系主任,南加州大学再生医学和干细胞研究Eli and Edythe Broad中心主任,他说:“这些类器官简单、可复制、可扩展,而且成本效益高。”“最重要的是,类器官可以持续再现正常人类肾脏发育的关键方面,以及ADPKD中的囊肿形成。”
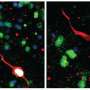
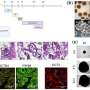
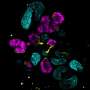
科学家们证明,类器官含有许多在胚胎发育过程中构建肾脏所需的细胞前体和遗传特征。当移植到老鼠体内时,类器官的肾样结构开始发育脉管系统,甚至达到了过滤废物的有限能力——这是肾脏最重要的功能之一。
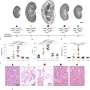
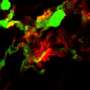
为了使类器官对研究ADPKD有用,科学家们使用CRISPR/Cas9基因编辑使其失活PKD1或PKD2.正如预期的那样,经过基因编辑的类器官开始形成囊肿,最终囊肿分离,直径增长到几厘米。
然后,科学家们使用基因编辑的人类类器官进行了第一次筛选,以确定ADPKD的潜在治疗药物,重点放在一系列酶抑制剂上,以深入了解控制囊肿形成的细胞机制。
“我们的类器官被证明对确定值得进一步研究的ADPKD治疗候选药物非常有用,”Song说,他是麦克马洪实验室的博士后安进学者。
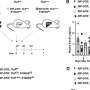
在对类器官上的247种酶抑制剂化合物进行测试后,科学家们发现有9种化合物可以抑制囊肿的生长,而不会阻碍类器官的整体生长。其中一种化合物,喹唑啉,尤其有效。
“在未来,类器官将成为一种越来越强大的工具,用于建模和理解人类疾病,确定潜在的治疗方法,并最终为患者提供移植以取代器官功能,”Tran说,他作为麦克马洪实验室的博士生进行了这项研究,目前是加州大学洛杉矶分校的博士后培训生。
其他共同作者包括南加州大学的阮楚恩、程顺阳、吉尔·a·麦克马洪、杨锐、郭秋玉、Balint Der和Nils O. Lindström,以及丹尼尔·c - h。在安进林。