当阿尔茨海默氏症的降解横穿半球的细胞时,视觉记忆会受到影响
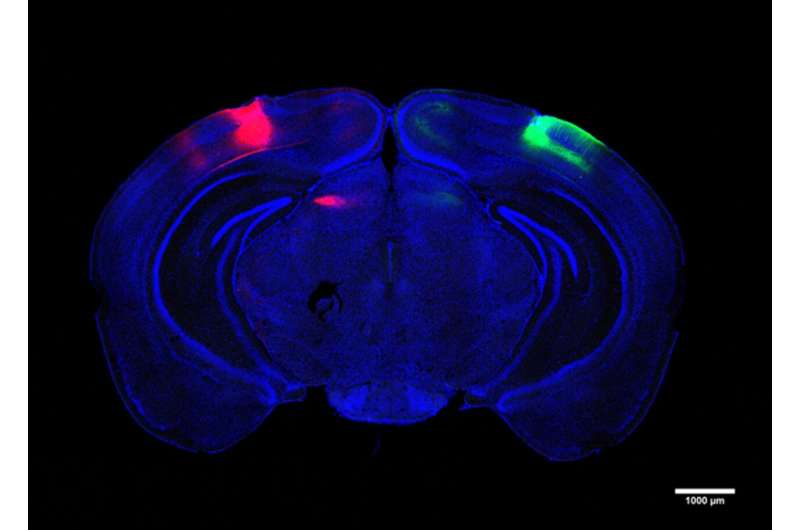
一项新的麻省理工学院研究发现,阿尔茨海默氏病通过降低连接每个大脑半球的视觉处理中心的新电路来破坏至少一种视觉记忆。
该研究的结果发表在神经元由皮科尔学习和记忆研究所的研究团队来自小鼠的实验,但为人类患者的先前观察提供了生理和机械基础:每个半球中对应区域之间脑节律同步的程度与每个半球之间的同步程度相关痴呆的临床严重程度。
首席作者Chinnakkaruppan Adaikkan说:“我们证明有一个功能巡回赛可以解释这一现象。”。“从某种意义上说,我们发现了以前未知的基本生物学。”
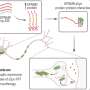
具体而言,Adaikkan的工作确定了连接的神经元主要视觉皮层(v1)每个半球,并表明,当细胞受到破坏时,通过对阿尔茨海默氏病进行建模或直接实验室扰动的遗传改变,脑节律同步会减少,而小鼠会明显减少何时出现在壁上的新模式时会注意到明显的注意力。在他们的围栏中。这种对新颖性的认识需要对去年的视觉记忆进行视觉记忆,这是阿尔茨海默氏症中通常破坏的能力。
研究高级作者Li-Huei Tsai说:“这项研究证明了γ节奏同步通过跨半球连通性传播。”“这也表明,在AD小鼠模型中,该电路的破坏与特定的行为缺陷有关。”
跨斜膜细胞
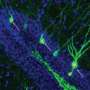
在研究中,Adaikkan,Tsai,Thomas McHugh和合着者发现并追踪了V1神经元,这些神经元将其轴突一直延伸到Callosum(将大脑半球连接到大脑对方的V1中的细胞)中。他们发现,在那里,跨垂直(CH)神经元伪造的连接或突触,带有靶细胞,为他们提供“兴奋性”刺激以推动其活动。Adaikkan还发现,与一般参与记忆(如海马或前额叶皮层)的其他区域中的V1神经元相比,CH神经元更有可能被新颖的歧视任务激活。
对阿尔茨海默氏病有何不同的好奇,小组研究了两个不同阿尔茨海默氏症小鼠模型中细胞的活性。发现在疾病中,CH细胞活性大大减少了。毫不奇怪,阿尔茨海默氏症的老鼠在新颖性歧视任务方面的表现要差得多。
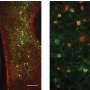
该小组密切检查了CH细胞,发现他们从其V1和其他区域内的各种细胞中收集了传入的输入,这些输入是过程视觉信息的。当他们比较健康的CH神经元与患有阿尔茨海默氏症患者的CH细胞中的传入连接时,他们发现疾病状况中的细胞在托管传入连接的基础设施中的基础设施明显较少(以突触的架构刺激从葡萄藤样刺出的突触架构来衡量。从细胞体中蔓延的树突)。
鉴于观察结果与阿尔茨海默氏症的脑节律同步和记忆力的减少相关联,该团队想知道这是否也发生在小鼠中。为了找出,他们定制设计的电极以同时在每个半球V1的所有皮层中测量节奏活性。他们观察到,当小鼠从事新颖性歧视时,跨半球同步在V1之间显着增加,但是在高“伽马”和较低的“ theta”频率节奏下,同步的同步均显着低于健康小鼠的小鼠中的同步性。。
当时Adaikkan的证据很强,但仍然只是暗示性的,CH神经元提供了一种手段,即大脑每一侧的V1区域都可以协调以实现新颖性歧视,并且这种能力因阿尔茨海默氏症的CH细胞的退化而破坏了这种能力。连通性。为了更直接地确定CH巡回赛是否扮演了这种因果关系,团队直接干预以破坏他们,并测试目标扰动的影响。
他们发现,化学抑制CH细胞破坏了V1之间的节奏同步,反映了阿尔茨海默氏症模型小鼠中做出的措施。此外,破坏CH活动破坏了新颖性歧视能力。为了进一步测试是否特别重要的是细胞的跨膜性质,它们设计了CH细胞可通过光闪烁(一种称为“光遗传学”的技术)来控制的。当他们在连接上发光时,他们在另一个半球锻造,抑制这些灯,发现这样做再次损害了视觉歧视能力。
总而言之,研究结果表明,V1中的CH细胞与相对半球的对应区域中的神经元相连,以同步适当识别新颖性所需的神经活动,但阿尔茨海默氏病损害了他们完成这项工作的能力。
阿达坎说,他很好奇现在看其他潜在的跨膜连接,以及它们在阿尔茨海默氏病中的影响。他说,他还想研究其他节奏频率同步的情况。