3D类器官模型确定了一种破坏性儿童肾脏疾病的潜在治疗靶点
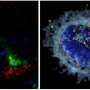
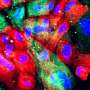
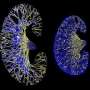
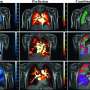
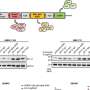
![CDH1<sup>+</sup> distal nephron dilates in <i>PKHD1<sup>−/−</sup></i> kidney organoids cultured under flow.(<b>A</b>) Schematic of kidney organoid-on-a-chip (flow) culture and static culture. (<b>B</b>) Diagram of differentiation days and culture conditions for flow and static culture. (<b>C</b>) Representative phase-contrast images of <i>PKHD1<sup>−/−</sup></i> and <i>PKHD1<sup>+/−</sup></i> organoids cultured under flow on days 16 to 18, days 21 to 25, and day 32 of differentiation. Red arrows highlight dilated tubules. Scale bars, 100 μm (top). Representative phase-contrast images of <i>PKHD1<sup>−/−</sup></i> and <i>PKHD1<sup>+/−</sup></i> organoids cultured under flow on day 35 of differentiation. White arrows highlight dilated tubules. Dashed white lines highlight normal tubules. Scale bar, 50 μm (bottom). (<b>D</b>) Immunocytochemistry with sample clearing for proximal tubule (LTL and CFTR) and distal tubule (CDH1) in <i>PKHD1<sup>−/−</sup></i> organoids with and without flow on day 35. Scale bar, 100 μm. (<b>E</b>) Bright-field images of patient-derived ARPKD organoids with and without forskolin treatment in 3D culture on day 66. Scale bar, 250 μm (top). Immunocytochemistry for proximal tubule (LTL), distal tubule (CDH1), and podocyte (PODXL) in <i>PKHD1<sup>−/−</sup></i> organoids with and without forskolin treatment on day 35. Scale bar, 100 μm (bottom). (<b>F</b>) Tubular diameters in nephron segments [proximal tubule (LTL) and distal tubule (CDH1)] in <i>PKHD1<sup>−/−</sup></i> organoids with and without flow (left) and with and without forskolin treatment (right). Values represent means ± SD. **<i>P</i> < 0.01, ****<i>P</i> < 0.0001. Credit: <i>Science Advances</i> (2022). DOI: 10.1126/sciadv.abq0866 3D类器官模型确定了一种破坏性儿童肾脏疾病的潜在治疗靶点](https://scx1.b-cdn.net/csz/news/800a/2022/3d-organoid-models-ide.jpg)
类器官——实验室培养的类似器官的细胞或组织——是疾病建模的新工具,但研究人员往往难以复制器官在体内运行的生物物理条件。
这对于需要细胞微环境刺激的人类疾病建模尤其正确。
来自马萨诸塞总医院、布里格姆妇女医院、威斯研究所的一个研究小组及其同事最近将类器官与organ-on-a-结合起来芯片技术复制常染色体隐性多囊肾病(APRKD)的独特疾病过程。
在最近一项研究中科学的进步该团队由Ken Hiratsuka医学博士和Ryuji Morizane医学博士领导,报告了使用新的建模系统识别APRKD的两种潜在治疗方法,目前fda还没有批准APRKD的治疗方法。
APRKD是一种以肾脏囊肿形成为特征的疾病,囊肿使肾脏肿大,导致肾功能进行性丧失。据报道,婴儿死亡率高达30%。在存活下来的患者中,41%的人在11岁前需要接受肾移植。
这种疾病的致病基因是PKHD1,但之前在转基因小鼠模型中建模这种疾病的尝试都没有成功。研究人员已经能够在实验室中培养突变的PKHD1细胞。然而,在静态的3D类器官中建模疾病是行不通的,因为它是由尿流刺激的细胞表面突变引起的。
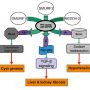
为了克服这一挑战,研究小组使用3D打印机制造了灌注芯片,该芯片模拟了肾脏内细胞的微环境,并允许液体流经类器官。通过这样做,研究小组确定了两种机械感应分子(FOS和RAC1),它们是该疾病潜在的治疗靶点。
他们还阐明了关于ARPKD疾病机制的两个重要问题:
- FOS分子可能是阻止物种特异性囊肿形成的关键因素,这解释了为什么小鼠模型不能有效复制疾病
- 为什么PKHD1基因突变会导致囊肿的形成
该团队还测试了两种fda批准的抑制RAC-1的药物(r -萘普生和r -酮洛act)和一种抑制FOS的正在研究的新药(T-5224),它们都在这些模型中显示有治疗效果。
现在需要进行临床试验来研究这些治疗方法在ARPKD患者中的作用。类器官建模系统在复制疾病方面的成功也可以帮助研究人员确定更多潜在的治疗靶点。
“在这项研究中,我们展示了我们的肾类器官在芯片平台上为ARPKD提供了一个生理相关模型,允许识别机械感应信号作为膀胱发生的关键驱动因素,”Morizane说,他是麻省总医院神经病学部门的研究员,也是哈佛医学院的医学助理教授。
“为了验证我们的研究结果,在我们的模型中,fda批准的抑制RAC1的非甾体抗炎药以及经临床测试的FOS抑制剂被证明具有治疗效果。我们的观察强调了芯片上的有机物模型在阐明治疗测试和发现的复杂疾病机制方面的巨大潜力。”