“芯片上的胎盘”模拟了受疟疾感染的母亲和胎儿之间的营养交换
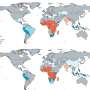
恶性疟原虫感染导致的胎盘疟疾可导致母亲和儿童的严重并发症。每年,胎盘疟疾造成近20万新生儿死亡,主要原因是出生体重过低,还有10 000名产妇死亡。胎盘疟疾是由受寄生虫感染的红细胞卡在构成胎盘的树状分支结构中引起的。
由于伦理因素和活体器官的不可及性,人类胎盘的研究在实验上具有挑战性。解剖人类胎盘母胎界面的结构,如母胎血液之间的结构,是复杂的,不容易用现代体外模型完整地重建。
佛罗里达大西洋大学工程与计算机科学学院和施密特医学院的研究人员开发了一种胎盘芯片模型,该模型模拟了胎盘疟疾影响下胎儿和母亲之间的营养交换。将微生物学与工程技术相结合,这个新颖的3D模型使用单个微流控芯片来研究感染疟疾的胎盘以及其他与胎盘相关的疾病和病理中发生的复杂过程。
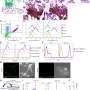
Placenta-on-a-chip模拟血液流动模拟感染疟疾的胎盘在这种流动状态下的微环境。通过这种方法,研究人员仔细检查了被感染的过程红细胞与胎盘血管系统相互作用。这种微型装置使他们能够测量葡萄糖在模拟的胎盘屏障上的扩散,以及被恶性疟原虫感染的血液的影响。恶性疟原虫可以通过胎盘表达分子CSA粘附在胎盘表面。
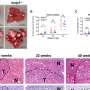
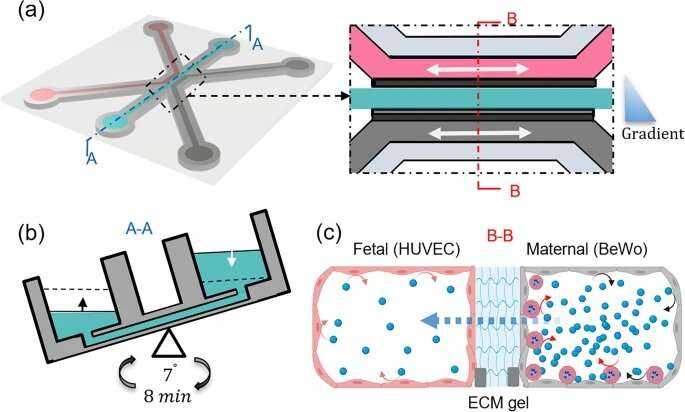
研究对象为胎盘和人脐静脉的滋养层细胞或外层细胞内皮细胞在隔室微流体系统中培养细胞外基质凝胶的两侧,在共流管状结构之间形成生理屏障,模拟胎盘绒毛中简化的母胎界面。
结果发表在科学报告研究表明,csa结合感染的红细胞增加了对模拟胎盘屏障葡萄糖灌注的抵抗力,并减少了葡萄糖通过该屏障的转移。当未感染或恶性疟原虫感染的血液在外层细胞上流动时,葡萄糖通过胎盘屏障的转运率的比较有助于更好地理解胎盘疟疾病理学的这一重要方面,并可能被用作研究胎盘疟疾治疗方法的模型。
“尽管在生物传感和活细胞成像方面取得了进步,但解释跨越胎盘屏障的运输仍然具有挑战性。这是因为胎盘营养运输是一个复杂的问题,涉及多种细胞类型、多层结构,以及细胞消耗和跨越胎盘屏障扩散之间的耦合,”资深作者、佛罗里达大学海洋与机械工程系副教授Sarah E. Du博士说。“我们的技术支持微工程胎盘屏障的形成,并模拟血液循环,这为检测和筛查提供了替代方法。”
母体和胎儿血液之间的大部分分子交换发生在被称为绒毛树的树枝状结构中。由于胎盘疟疾可能只在孕中期开始后才发生,此时绒毛间间隙向受感染的红细胞和白细胞开放,因此研究人员对孕中期形成的母胎界面的胎盘模型很感兴趣。
佛罗里达大学工程与计算机科学学院院长Stella Batalama博士说:“这项研究提供了受疟疾影响的母亲和胎儿之间营养交换的重要信息。”“研究母体和胎儿隔室之间的分子运输可能有助于理解胎盘疟疾的一些病理生理机制。重要的是,我们佛罗里达大西洋大学的研究人员开发的这种新型微流体设备可以作为其他胎盘相关疾病的模型。”