寻找缺失的基因和癌症线索
基因突变引发癌症。一些突变打乱了遗传密码,另一些则来自关键基因的缺失。
在拉霍亚免疫研究所(LJI),研究人员在理解编码TET蛋白的基因缺失如何导致乳腺癌方面取得了重大突破肿瘤生长.他们的新研究发表在自然通讯这是第一个显示删除小鼠胚胎干细胞中TET家族所有三个基因的直接后果的研究细胞.
通过使用这个小鼠模型,研究人员发现TET蛋白对保持细胞和DNA复制过程的平稳运行至关重要。没有TET蛋白,重要的基因就会丢失,导致突变或非整倍体(an-new-ploy-dee)。
非整倍体是指基因物质被大量添加或删除的情况。有非整倍体的细胞不只是缺少一个基因。相反,整个染色体上的基因都丢失了。“非整倍体是癌细胞的共同特征,”LJI博士后研究员Hugo Sepulveda博士说。
发现这直接连接在TET丧失功能和非整倍体之间的联系是细胞生物学领域的一个重大发现,它为研究人员找到支持癌症发展的基因提供了线索。“我们现在可以理解非整倍体发展背后的机制,尽管我们不能说这些变化总是通过其他基因的相同基因发生细胞类型LJI博士后研究员Hugo Sepulveda博士说。
Sepulveda与前LJI博士后研究员Romain Georges博士共同领导了这项研究,后者为该项目生成了小鼠模型并获得了干细胞。LJI教授Anjana Rao博士是这项研究的资深作者。
TET蛋白是什么?
作为哈佛大学的一名研究人员,Rao与Mamta Tahiliani博士和L. Aravind博士一起发现了TET蛋白家族。从那时起,她的工作表明TET蛋白在细胞生长和发育中起着关键作用。TET蛋白可以防止致癌突变,甚至可以预防炎症和心血管疾病。TET蛋白在细胞中具有如此重要的作用,因为它们影响DNA甲基化,这一过程改变了DNA的读取和基因的表达方式。
Rao的工作对于理解TET在免疫细胞(如T细胞、B细胞和髓样细胞)中的功能尤其重要。“Rao博士表明,每当这些细胞中有一个TET基因的缺失,你就会看到一种不同的侵袭性癌症的发展,”Sepulveda说。
随着研究的继续,LJI团队注意到一些奇怪的现象——TET蛋白缺失或受损的细胞也倾向于发生非整倍体。这是TET蛋白质和癌症之间的另一种联系。
TET功能丧失的细胞易发生非整倍体,癌细胞易发生非整倍体。但是什么是最重要的呢?TET功能丧失是否会引发非整倍体和癌症,还是相反?
一个令人兴奋的发现
为了更好地了解癌症,Georges和Sepulveda将小鼠胚胎干细胞作为模型。这些细胞自然地处于快速分裂的状态,但不容易发生癌症。研究人员需要看看删除TET蛋白会如何改变情况。
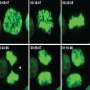
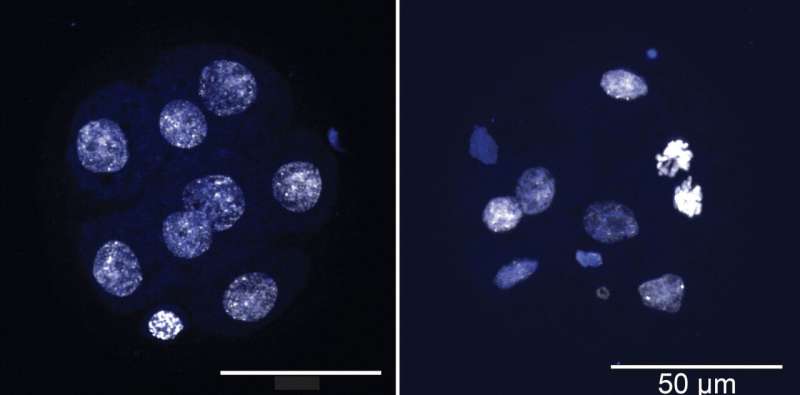
Georges、Sepulveda和他们的同事们一次又一次地发现,TET缺失的细胞发生非整倍体的速度是正常细胞的三倍。这些改变的细胞失去基因非常迅速和随机。科学家们可以在只有8个细胞的非常早期的胚胎中看到这种影响。
Sepulveda说:“这证明了TET缺失对非整倍体有直接影响。”“这非常令人兴奋,以前从未展示过。”
接下来,研究人员转向一种名为RNA-seq的测序技术,以观察TET缺失对其他基因的影响。他们看到了与细胞和DNA复制相关的某些基因的“下调”或关闭。这一发现表明TET的缺失对维持细胞正常分裂的系统是一个重大打击。
那么到底是哪些基因造成的呢?
小鼠胚胎干细胞中的TET缺失似乎对一种叫做Khdc3它属于一个系统或复合体,此前曾因其帮助卵母细胞分裂的活性而被研究。这个复合体还没有得到很好的研究,但是Khdc3在受精前后和胚胎发育的早期阶段,对维持卵母细胞的基因组稳定性非常重要。
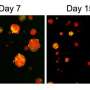
当研究人员恢复这些细胞中的KHDC3蛋白功能时,他们惊讶地发现基因组的稳定性也恢复了。非整倍性逆转。Khdc3所在的复合体重新开始工作。
这项新研究揭示了关于TET功能丧失的两个关键事实。首先,TET功能的丧失是与癌症相关的非整倍体的直接原因,因为它导致了hdc3表达的减少。第二,胚胎干细胞中TET功能的丧失通过一些含有khdc3的复合体影响基因组的稳定性。
Sepulveda谨慎地指出,hdc3复合体只在早期胚胎发育和胚胎中活跃干细胞.这意味着,即使在缺乏tet的癌症中发现了非整倍体,科学家还需要确定这些癌症是否上调了KHDC3(大多数癌症倾向于上调胚胎基因),如果是这样,它们发展的非整倍体是否是由异常的KHDC3功能引起的。
值得注意的是,非整倍体出现在许多TET未突变的癌症中,但这些癌症可能因为代谢紊乱而失去TET功能。
Sepulveda说:“癌细胞中的基因组不稳定可能是通过khhdc3以外的基因发生的,但可能是通过一种类似的调节机制发生的,这也涉及到DNA甲基化模式的变化。”“tet相关的癌症是否通过调节失调发展成非整倍体基因仍然是一个悬而未决的问题。”
展望未来,Sepulveda希望确切地发现khhdc3复合体是如何促进TET蛋白质下游的基因组稳定性的胚胎干细胞.
进一步探索