研究发现疼痛具有意想不到的保护作用
长期以来,疼痛一直被认为是进化过程中最可靠的工具之一,用来检测伤害的存在,并发出出错的信号——这是一种警告系统,告诉我们暂停并注意自己的身体。
但是,如果疼痛它不仅仅是一个警钟吗?如果疼痛本身就是一种保护呢?
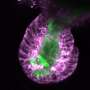
哈佛医学院的研究人员领导的一项新研究表明,这种情况很可能发生在老鼠身上。这项研究发表在10月14日的细胞,表明小鼠肠道中的疼痛神经元在正常情况下调节保护性粘液的存在并产生刺激肠细胞在炎症状态下释放更多粘液。
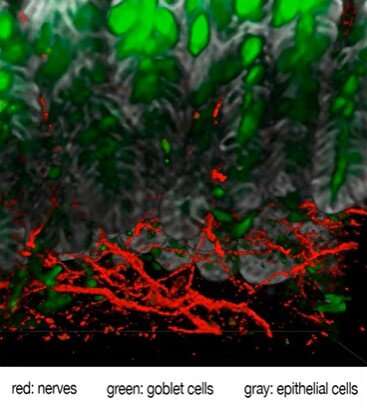
这项工作详细描述了复杂信号级联的步骤,显示疼痛神经元与含有黏液的肠道细胞(杯状细胞)进行直接的串扰。“事实证明,疼痛可能以更直接的方式保护我们,而不是检测潜在伤害并向大脑发送信号的传统工作。我们的工作显示了肠道中的疼痛调节神经是如何与肠道周围的上皮细胞对话的,”该研究的高级研究员艾萨克·邱(Isaac Chiu)说,他是HMS布拉瓦特尼克研究所的免疫生物学副教授。这意味着神经系统除了给我们带来不愉快的感觉外它在肠道中也起着重要作用它在维持肠道屏障方面也起着关键作用保护机制在炎症。”
直接对话
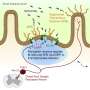
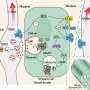
我们的肠道和气道布满了杯状细胞。杯状细胞因其杯状外观而得名,它含有凝胶状的粘液,由蛋白质和糖组成,起到保护涂层的作用,保护器官表面免受磨损和损伤。这项新研究发现,当肠道杯状细胞与肠道中的痛觉神经元直接相互作用时,会释放保护性粘液。
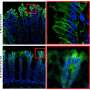
在一系列实验中,研究人员观察到,缺乏疼痛神经元的小鼠产生的保护性粘液更少,肠道微生物组成也发生了变化,即有益和有害微生物的不平衡,即生物失调。为了弄清这种保护性的串扰是如何发生的,研究人员分析了杯状细胞在疼痛神经元存在和不存在时的行为。
他们发现杯状细胞的表面含有一种被称为RAMP1的受体,它能确保细胞对相邻的疼痛神经元做出反应,这些神经元会被饮食和微生物信号、机械压力、化学刺激或剧烈的温度变化激活。实验进一步表明,当疼痛神经元受到刺激时,这些受体会与一种名为CGRP的化学物质相连接,这种物质会由附近的疼痛神经元释放。研究人员发现,这些RAMP1受体也存在于人类和老鼠的杯状细胞中,因此使它们对疼痛信号有反应。
实验进一步表明,某些肠道微生物的存在激活了CGRP的释放,以维持肠道内稳态。
“这一发现告诉我们,这些神经不仅会被急性炎症触发,也会在基线时触发,”Chiu说。“只要有常规的肠道微生物在周围,似乎就能刺激神经,使杯状细胞释放粘液。”Chiu说,这个反馈回路确保了微生物向神经元发送信号,神经元调节黏液,黏液保持肠道微生物的健康。
研究表明,除了微生物的存在,饮食因素也在激活疼痛感受器中发挥了作用。当研究人员给老鼠喂辣椒素时,老鼠的疼痛神经元迅速被激活,致使杯状细胞释放大量的保护性粘液。辣椒素是辣椒中的主要成分,以能引发剧烈的急性疼痛而闻名。
相比之下,缺乏CGRP疼痛神经元或杯状细胞受体的小鼠更容易患结肠炎(一种肠道炎症)。这一发现可以解释为什么肠道菌群失调的人更容易患结肠炎。当研究人员给缺乏疼痛神经元的动物注射疼痛信号CGRP时,小鼠的粘液分泌迅速增加。即使在疼痛神经元缺失的情况下,这种治疗也能保护小鼠不患结肠炎。
这一发现表明,CGRP是导致分泌保护性粘液的信号级联的关键刺激因子。
“疼痛是肠道慢性炎症的常见症状,如结肠炎,但我们的研究表明,急性疼痛也起着直接的保护作用,”该研究的第一作者杨大平说,他是邱实验室的博士后研究员。
这可能是抑制疼痛的一个缺点
该团队的实验表明,当结肠炎发生时,缺乏疼痛感受器的老鼠也会受到更严重的伤害。研究人员说,鉴于止痛药通常用于治疗结肠炎患者,考虑到阻断疼痛可能产生的有害后果可能是很重要的。
Chiu说:“肠道炎症患者的主要症状之一是疼痛,所以你可能会认为我们想要治疗和阻断疼痛来减轻痛苦。”“但这种疼痛信号的某些部分可能作为一种神经反射直接起到保护作用,这就提出了一个重要的问题,即如何在不导致其他伤害的情况下小心地管理疼痛。”
此外,研究人员说,一类抑制CGRP分泌的常见偏头痛药物可能通过干扰这种保护性疼痛信号而破坏肠道屏障组织。
考虑到CGRP是杯状细胞功能的中介粘液生产,如果我们长期阻断偏头痛患者的这种保护机制,如果他们长期服用这些药物,会发生什么?”邱说。“这些药物会干扰粘膜内膜和人的微生物群吗?”
杯状细胞在肠道中有多种其他功能。它们为抗原(病毒和细菌上发现的蛋白质,可启动机体保护性免疫反应)提供通道,并产生抗菌化学物质,保护肠道免受病原体的侵害。“从我们目前的工作中产生的一个问题是,疼痛纤维是否也调节这些其他功能杯状细胞,”杨说。
Yang补充说,另一个研究方向是探索CGRP信号通路的中断,并确定是否在炎症性肠病遗传易感性患者中起作用。
进一步探索