锌可以治疗一种罕见的遗传疾病
遗传性儿童脑病从出生起就会引起严重的运动和智力障碍。其中一种疾病于2013年首次被发现,是由GNAO1基因突变引起的。为了了解由此产生的扰动的更详细细节,日内瓦大学(UNIGE)的科学家进行了原子、分子和细胞分析。
他们发现GNAO1的突变会导致一种氨基酸被另一种氨基酸取代蛋白质序列.这足以破坏编码蛋白质的激活和失活机制,从而改变神经元与环境正确通信的能力。
一个简单的锌分子,通常用于其他情况,可以恢复,至少部分,受这些影响的蛋白质的功能突变.这些研究结果发表在该杂志上科学的进步,让人们看到了一种可以改变患者及其家人生活的治疗方法的希望。
GNAO1基因突变的儿童表现出明显的临床疾病:智力和运动发育迟缓,运动不可控,以及或多或少严重的癫痫,有时还伴有脑损伤和萎缩。GNAO1编码一种名为“Gαo”的蛋白质,这是神经元细胞最重要的组成部分之一。
“这种突变是杂合显性的,这意味着基因的两个副本中的一个是功能性的,另一个是突变的,”领导这项研究的UNIGE医学院细胞生理学和代谢系教授Vladimir Katanaev解释说。“即使神经元只有正常蛋白质的一半,神经发育的结果也是毁灭性的。”
修饰过的单一氨基酸
功能Gαo蛋白在与称为GTP的核苷酸结合时被激活,然后通过水解而失活。这使得蛋白质遵循细胞功能所必需的激活和失活周期。
GNAO1基因突变导致Gαo中的一个氨基酸被另一个氨基酸取代。这些突变的蛋白质很快被激活,但不能水解。因此,它们被困在一个永久的激活状态中。
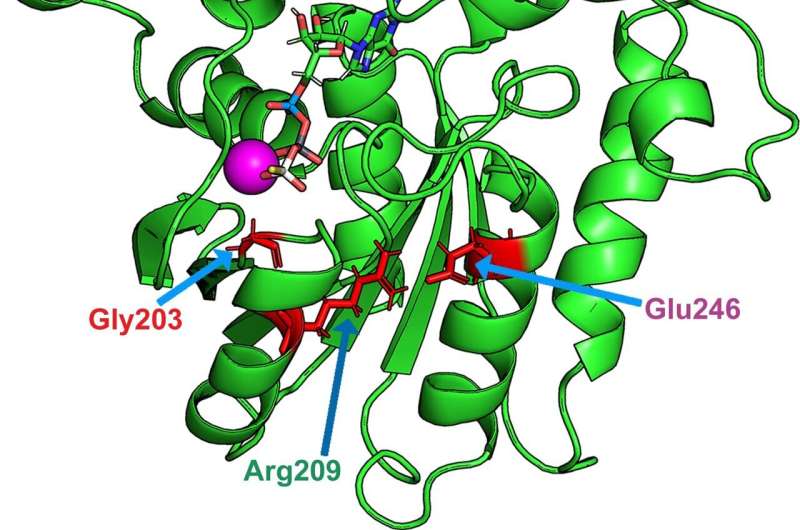
“这些突变被发现间接影响GTP水解的关键氨基酸:谷氨酰胺205。通常情况下,这种谷氨酰胺在结构上位于GTP的对面,这允许水解。然而,这种谷氨酰胺在病理突变的情况下会发生位移:这种结构距离阻止了这种机制的发生,”Vladimir Katanaev解释道。
通过破坏与细胞膜蛋白的相互作用,这些突变改变了神经元与环境通信的能力。
一种已知了几十年的分子
科学家们基于这些初步的基本结果进行了其余的研究。“最终,我们的目标是试图找到一种治疗方法,可以限制这种疾病的症状,改善患者及其家人的生活质量。”
为了做到这一点,研究小组进行了高通量筛选成千上万种被批准的药物,他们的想法是识别一种能够重新激活水解的分子。“事实上,在罕见疾病在美国,通常没有办法开发一种全新的分子。相反,重新利用已经获得的、批准的和安全的药物分子可能是一种成功的策略,”Vladimir Katanaev补充说。
其中一种分子,吡啶硫锌,表现突出:它通过使谷氨酰胺205接近其正常结构位置,纠正细胞内相互作用的损失,使GTP水解发生。
“这是一种古老的抗真菌和抗菌药物,以膏状形式用于治疗某些皮肤病。我们进一步分析了这种分子是否全部或部分有效。事实证明,这里有效的是锌离子。很容易在任何药店找到,它已经被批准用于治疗轻度抑郁症,失眠,甚至在一些发育障碍弗拉基米尔·卡塔纳耶夫说。
一个苍蝇模型证实了这些结果
为了证实这一结果,研究小组使用了一种创新的动物模型:果蝇。弗拉基米尔·卡塔纳耶夫实验室的研究员、果蝇疾病建模专家米哈伊尔·萨维茨基(Mikhail Savitskiy)解释说:“我们修改了果蝇的基因组,复制了GNAO1基因的突变,保留了人类基因的正常副本。”
“果蝇有行动不便的问题,寿命也缩短了。”然而,从幼虫时期开始,在它们的饮食中添加锌,使它们几乎完全消除了这些症状。“这个结果真的很惊人,尤其是锌是一种非常安全、耐受性好、价格便宜的物质。”第一批患者试验看起来很有希望;临床试验现在将被建立起来,以评估是否可以在长期内衡量改善。