这一发现可能会带来阻断引发肠癌的蛋白质的新药

科学家们已经揭示了一种涉及广泛细胞过程的关键蛋白质的内部工作原理,这可能为研制更好、毒性更小的抗癌药物铺平了道路。
利用获得诺贝尔奖的显微镜技术,研究人员揭示了tankyrase蛋白是如何通过自我组装成3D链状结构来开关自身的。
他们的研究发表在杂志上自然,揭示了对难以捉摸但重要的tankyrase蛋白的关键结构洞察,该蛋白在帮助驱动方面发挥着特别重要的作用肠癌.
伦敦癌症研究所的科学家们相信,他们的研究将打开新型癌症的大门癌症能比目前更精确地控制酸橙酶的治疗方法,副作用更少。
这一基本发现可能会对治疗各种癌症、糖尿病、炎症、心脏和神经退行性疾病产生影响。
Tankyrase是一种支持“Wnt信号”的重要蛋白质,这种信号对身体维持至关重要干细胞并执行这样的过程细胞分裂但如果不受控制,就会引发肠癌等疾病。Tankyrase还控制着其他对癌症至关重要的细胞功能,比如染色体末端端粒的维护。
与来自同一“PARP家族”的PARP1蛋白不同,tankyrase对它的了解仍然很少。虽然阻断PARP1的药物已经进入临床,但科学家们仍然没有完全理解tankyrase是如何启动的,它是如何工作的,以及如何阻断它而不导致不必要的副作用。
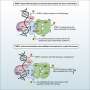
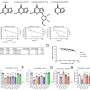
在这项研究中,科学家首次将PARP1和tankyrase的激活机制进行了比较。他们认为,与PARP1相似,tankyrase的工作原理是被招募到一个特定的位点并“自我组装”,聚集和改变其3D结构来激活自己并执行其功能。
在过去的十年里,科学家们已经开发出阻断tankyrase的药物,试图治疗肠癌,但由于Wnt信号通路参与了广泛的过程,这些药物导致了太多的副作用,以致于无法进入临床试验。
为了真正了解坦克酶抑制剂是如何工作的,以及如何开发毒性更小的治疗方法,ICR的科学家们开始使用先进的冷冻电子显微镜来发现新的结构信息。这种功能极其强大的显微镜将样品冻结在-180°C,使蛋白质形状的微小细节得以成像。
这种方法使他们能够可视化并捕捉到酸橙酶是如何“自我组装”成纤维链状结构的,以及为什么酸橙酶需要纤维的形成来激活自己。
研究人员认为,“结构域”——蛋白质中与不同功能相关的特定区域——允许酸橙酶组装和分解成不同的结构,是未来抗癌药物令人兴奋的靶点。他们还认为,取决于药物结合的结构域,不是所有的tankyrase抑制剂都会以相同的方式影响Wnt信号。
希望研究人员能够设计出结构上不同的tankyrase抑制剂——更安全、更有效的抑制剂,这是治疗肠癌和其他与tankyrase有关的疾病急需的。
该研究的领导者、伦敦癌症研究所结构生物学部门的副主任Sebastian Guettler教授说:“我们的研究为一种名为tankyrase的特殊蛋白质分子提供了重要的新信息,这种蛋白质分子在肠癌和其他疾病中发挥着重要作用,但迄今为止我们一直无法理解。”我们正在迎头赶上——我们有所有这些药物来阻止酸橙酶的产生,但我们没有足够的基本知识来将它们用于治疗。”
“我们已经展示了tankyrase是如何启动的,并可以从一个‘懒惰的’酶变成一个活跃的酶。如果我们能创造出更好、毒性更小的药物来控制这一过程,我们就可以为未来有效的肠癌治疗铺平道路。”
伦敦癌症研究所的首席执行官Kristian Helin教授说:“这些基本发现帮助我们了解极其重要的tankyrase蛋白是如何在细胞内工作的。几乎所有的肠癌都有过度活跃的wnt信号,这种信号通过tankyrase起作用,因此它们可能会被靶向药物治疗。”
“我希望这些在我们理解tankyrase方面的关键进展将帮助我们克服目前可用的限制药物希望能让我们离新的肠癌靶向疗法更近一步。Tankyrase还负责调节与多种疾病相关的一系列过程,而不仅仅是癌症,所以这项研究可能具有广泛的意义。”
英国癌症研究中心的研究信息经理玛丽安·贝克博士说:“parp可以帮助癌细胞修复受损的DNA,因此它们是抗癌药物的关键靶点。我们很自豪能够支持这项研究,它建立了对较少研究的tankyrase parp的知识,并可以帮助为 未来的新治疗铺平 道路。”
“这篇论文是一个重要发现研究的例子,它加深了我们对生物学的理解,这对设计新的抗癌药物至关重要。”
“这也建立在英国癌症研究中心PARP抑制剂的成功历史上。在20世纪90年代,由英国癌症研究资助的ICR科学家在开发抑制PARP蛋白和阻止癌细胞自我修复的药物 方面发挥了关键作用。现在全世界 有成千上万的人接受这些治疗。”