心脏移植后的免疫抑制方案可能阻碍纤维化的良好治疗进展
吉田良典(Yoshinori Yoshida)实验室报告了从iPS细胞中提取的人类心脏类器官平台的生成,他们用它来测试心脏纤维化的新治疗替代方案。他们的研究发表在细胞与发育生物学前沿“,.
接受a心脏移植手术必须终生服用免疫抑制剂。否则,他们的身体可能会识别新心如外国而攻击它。多年来,美国食品和药物管理局(FDA)已经批准了几种药物来减弱免疫系统对固体器官移植的反应,让这些患者活下来。
这些被批准的药物包括他克莫司(钙调磷酸酶抑制剂)和西罗莫司(mTOR信号通路抑制剂)。虽然这些药物能对免疫细胞,它们对其他细胞的影响还不完全清楚。大部分的研究都是在动物模型上进行的人体临床试验病人生存的好处比长期健康更重要。
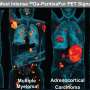
人类诱导多能性能细胞的3D模型的生成,重新创造了器官的功能,这有助于理解药物对不同细胞类型的长期影响。吉田良典(Yoshinori Yoshida)实验室的一项新研究报告称,在实验室中使用iPS细胞制造迷你人类心脏,并在多细胞水平上审问药物管理中的问题。
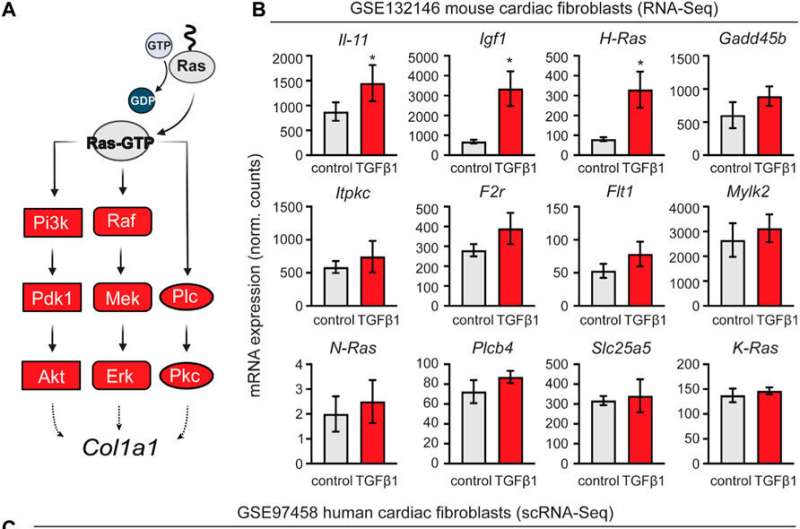
心脏中的成纤维细胞是构成心脏细胞组成的重要组成部分。在心脏移植或心脏损伤后,心脏成纤维细胞主要负责损伤后的再激活,产生纤维化和瘢痕。同时,这种反应并不理想,不能完全恢复心脏功能。因此,需要避免实体器官移植的治疗方法,而能够改善纤维化的药物对于适当的器官相容性是必不可少的。迄今为止,只考虑成纤维细胞的实验被用来发现新的纤维化治疗方法。尽管如此,细胞间的相互作用在确定治疗反应中是必不可少的。
一般来说,人类心脏的多细胞模型与只使用一种细胞的过度还原模型的行为不同。
“我们现在可以用人类iPS细胞创建多细胞类器官模型来研究心脏功能和对药物的反应,这将在重新质疑为什么我们可以观察到许多治疗在临床试验层面失败的许多方面发挥根本作用。”许多有前途的化合物都有不良的副作用。现在我们可以开始回答许多问题,并找到心脏病的新解决方案。这是一个游戏规则的改变者,”该研究的第一作者于田说。
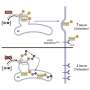
为了开发这种多细胞性,她和同事们将人类iPS细胞分化为人类心脏类器官,并刺激它们在疾病背景下的行为。
“在同时治疗多种疾病时,用不同的药物方案治疗患者是一种常见的做法,但我们没有正式调查它们之间的相互作用。此外,在过渡到临床试验之前,我们没有可靠的细胞工具在生理学相关平台上调查这些治疗的效果。再现心脏生理学的3D模型是新的前沿领域。心脏类器官区别于人类iPS细胞的可能性将我们带到了实验室,使我们重新定义一些迄今为止被认为是安全的治疗概念,”CiRA副教授Yoshinori Yoshida说,他领导了这项研究。
使用心脏类器官可以减少药物试验的人工和成本。此外,它还产生了可靠的信息来源,可以在以后开展新的人体临床试验时作为可靠的证据转移。
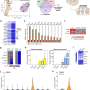
这项研究显示了一种很有前景的化合物,一种蛋白p38的抑制剂,可以改善心脏纤维化。P38是一种已知的在细胞中有多种作用的蛋白质,但研究表明,当它被抑制时,对治疗心脏纤维化有用。值得注意的是,p38抑制剂在心脏成纤维细胞中显示阳性结果,而在心脏类器官中与免疫抑制剂联合治疗显示相反的结果,这可能反映了不同的心脏细胞对心肌梗死的反应的贡献和调节的重要性药物.
因此,在分化为心脏类器官的iPS细胞的实验室中评估心脏疾病最安全的治疗组合是一种可行的可能性,可能有助于在临床前水平评估治疗反应,使研究人员能够为患者做出更好的决定。
助理教授Antonio Lucena-Cacace是这项研究的资深作者,他补充说,这些发现也为治疗心脏病的临床前模型的未来方向提供了线索。
“这不是一个决定性的解决方案。整合不同视角的模型应提供应在多学科科学背景下理解的全面方面。然而,我们的发现为扩大我们的实验提供了可能性,我们可以在一个培养皿中模拟任何心脏疾病,并找到在临床试验中获得成功的更大可能性的解决方案。”