科学家在首次虚拟临床试验中对两种阿尔茨海默病药物进行了面对面测试
据估计,有620万65岁及以上的美国人患有阿尔茨海默病。全国老年痴呆症协会预测到2060年,这一数字将增长到1380万,除非在预防、减缓或治愈这种使人衰弱的疾病方面取得医学突破。
科学家们可能离这一突破又近了一步,这要归功于一种史无前例的计算机模型,该模型成功模拟了一项临床试验,评估了多种治疗阿尔茨海默病(AD)的疗效。
宾夕法尼亚州立大学数学副教授郝文瑞说:“我们称之为虚拟临床试验,因为我们使用了真实的、去身份化的患者数据来模拟健康结果。”郝文瑞是该研究的第一作者和首席研究员,该研究发表在9月份的杂志上PLoS计算生物学.
“我们的发现几乎与之前临床试验的结果完全一致,但由于我们使用的是虚拟模拟,我们有一个额外的好处,可以直接比较不同药物在更长的试验期间的疗效。”
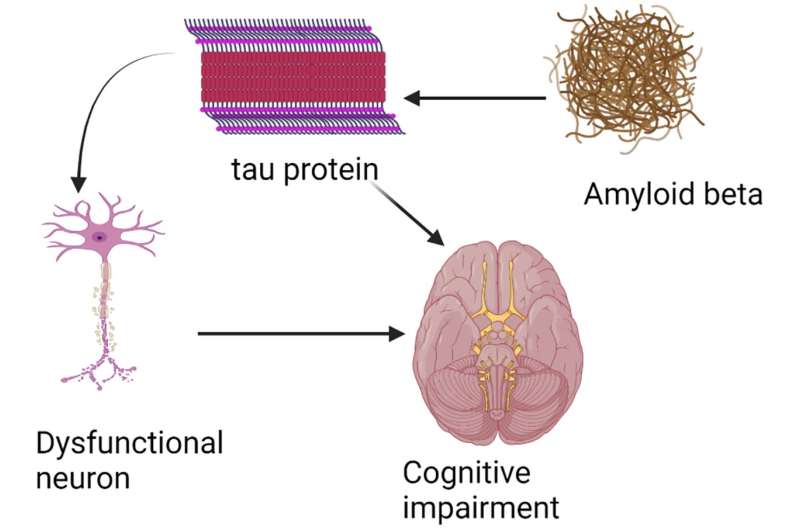
利用临床和生物标志物数据,研究人员建立了一个计算因果模型,对fda批准的治疗药物aducanumab以及另一种正在评估的有前景的治疗药物donanemab进行虚拟试验。这两种药物是首批针对可能导致疾病的因素而设计的治疗方法,而不仅仅是治疗症状。
研究人员将aducanumab的低剂量(6 mg/kg)和高剂量(10 mg/kg)方案和donanemab的单剂量(1400 mg)方案设置为中期(78周)和长期(10年)的试验时间表。这与fda批准的人体试验中使用的剂量相同。
他们的结果证实了实际临床试验中的发现。这两种药物对清除都有巨大而持久的效果β-淀粉样蛋白斑块这是阿尔茨海默病患者大脑中发现的一种肽。研究小组还发现,这两种治疗方法对减缓速度都有很小的影响认知能力下降在患者中,多纳单抗的疗效略高于aducanumab在模拟的10年期间。
杜克大学放射学教授、阿尔茨海默成像研究实验室主任杰弗里·佩特雷拉博士是这项研究的合作者和联合首席研究员,他说:“目前有10多种抗淀粉样蛋白疗法正在开发中,一个重要的问题是哪一种更好。”“通常需要花费数千万美元和多年的时间来进行药物的正面比较。我们的研究表明,这两种抗淀粉样蛋白药物在减缓认知能力下降方面的作用实际上相当有限——如果在晚年服用,几乎检测不到。”
Petrella解释说,医学界对去除淀粉样斑块的疗效以及这种每月静脉注射的治疗是否真的能预防或延缓认知能力下降仍存在疑问。
研究人员写道:“这种不确定性,加上其他类型的AD治疗试验99%的失败率,根源在于对导致AD的复杂机制的不完全理解,以及疾病轨迹和对治疗的反应如何因人而异。”“因此,个性化治疗可能需要在未来AD患者的管理和咨询中发挥核心作用。”
研究人员还利用他们的模型为每个虚拟患者制定个性化的治疗方案,同时考虑到抗淀粉样蛋白疗法的潜在副作用,如脑肿胀和出血、头痛、头晕、恶心、思维混乱和视力问题。研究小组的结果表明,最佳治疗方案逐渐增加剂量,直到达到最大剂量,并继续保持稳定状态。
参与这项研究的田纳西大学诺克斯维尔分校的数学教授苏珊娜·伦哈特说:“我们的目标是尽量减少认知能力下降,同时尽量减少治疗剂量,以限制相应的副作用。”“我们的模型将在一段时间内给出药物的最佳治疗水平,但更重要的是,它为每个患者提供了最佳的个性化治疗计划。”
利用他们开发的框架,研究人员现在将寻求将最佳治疗计算建模应用于目前正在评估的其他单一和联合AD疗法,并将新的临床试验数据纳入他们的模型中。
研究人员承认,这种虚拟试验包含了关于疾病发病机制、治疗机制、副作用和许多其他可能影响结果的因素的大量基于证据的假设。
“尽管存在这些限制,但这是迈向量身定制临床试验的第一步,”Petrella说。“我们已经证明了这种模式是可行的。我设想它将被用作一种精确的工具,以加强实际的临床试验,优化单个患者的药物剂量和组合。”